文章目录
间充质干细胞研究
MSC可以根据微环境,通过抑制T细胞、B细胞、DC细胞、NK细胞,从而释放抑制因子、刺激因子或表达其它表面分子来发挥其免疫调节功能。研究人员还发现,无血清条件下培养的MSC比传统的含血清培养基培养的MSC对免疫细胞的免疫抑制作用更大。
1.人间充质干细胞研究刚需
间充质干细胞(MSCs)是从骨髓、脐带、脂肪、胎盘、牙髓、骨骼肌、羊水和滑膜等组织中分离出来的一群表型与功能异质性的细胞。其具有如下特征:
贴壁培养,具有自我更新能力;
形态类似于成纤维细胞;
具成纤维细胞集落形成单位(CFU-F)的能力;
具有分化为成骨、脂肪和软骨细胞的潜能。
间充质干细胞(MSCs)具有多向分化潜能、能支持造血和促进造血干细胞植入、调节免疫以及分离培养、操作简便等特点,正日益受到再生医学领域的关注。作为种子细胞, 在临床上MSCs常被用于修复组织细胞和器官损伤等多种难治性疾病;作为免疫调节细胞,治疗免疫排斥和自身免疫性疾病。但由于MSCs本身在组织中含量少,因此必须将MSCs在体外加以扩增,以获得足够的数量,才可以用于研究和临床应用。而在无无异种动物源成份的培养基中扩增人MSCs,避免了血清批次之间差异的影响,减少了由血清带来的病毒、支原体等潜在病原污染的危险,提高了培养细胞的质量。鉴于此,我公司推出了用于人MSCs的HapCult TM人间充质干细胞培养基可帮助研究人员将使用的细胞培养系统加以标准化,并克服细胞培养基存在的批间差异问题。使用该培养基培养的脐带MSC高表达CD73、CD90、CD105,几乎不表达CD34和CD45。
我公司提供的人MSCs研究的系列产品:
|
|
分选及原代细胞 |
|
培养 |
|
|
冻存 CryoStor CS10(#210102) |
|
|
分化 MesenCult™-ACF软骨细胞分化培养基(#05455) 油红O(#G1262) 甲苯胺蓝(G2543) 茜素红S染液(0.2%,PH8.3)(#G1450) |
|
|
辅助产品 ALDEFLUORTM检测试剂盒(#01700) CD73 Monoclonal Antibody (AD2), PE(#12-0739-42) CD90 (Thy-1) Monoclonal Antibody (eBio5E10 (5E10)), PE(#12-0909-42) CD105 (Endoglin) Antibody (SN6), PE(#12-1057-42) |
使用HapCult TM人间充质干细胞培养基培养脐带MSC流式鉴定

2.MSC无血清培养
HapCult TM人间充质干细胞培养基优势
- 成份明确- 无血清- 优化可用于培养原代的MSCs细胞- MSCs扩增效率高- 批间差异最低 |
图1:HapCult TM人间充质干细胞培养基培养的脐带来源MSCs呈现MSCs细胞表型
培养操作流程
1、 将冻存的培养基置于冰上溶解 1~2 小时或者 2-8℃过夜,解冻后轻轻的充分混匀。
注:解冻后,应尽快使用,避免反复冻融。若置于 2-8℃,需在两周内使用。
3.MSC 标志物分子鉴定
人MSC细胞:CD73+ CD90+ CD105+CD34- CD45- CD11b- CD14- CD19- HLA-DR- CD79a-(CD44+)。
Real-time quantitative PCR (qRT-PCR):
| Gene | Primers | Gene | Primers | |
| CD73 | F:CGCAACAATGGCACAATTAC | Nestin | F: ACCTCAAGATGTCCCTCAGC | |
| R:CAGGTTTTCGGGAAAGATCA | R: TGGGAGCAAAGATCCAAGAC | |||
| CD90 | F:TCGCTCTCCTGCTAACAGTCT | |||
| R:CTCGTACTGGATGGGTGAACT | ||||
| CD105 | F: CACTAGCCAGGTCTCGAAGG | |||
| R: CTGAGGACCAGAAGCACCTC |
Reverse transcriptase-polymerase chain reaction (RT-PCR)
| Gene | Primer sequences (5'-3') | Size (bp) | PCR 条件: |
| Osteocalcin | 5'-CATGAGAAGCCCTCACA-3' | 310 | 1 cycle of 94℃ for 3 min;35cycles of 94℃ for 30 s,55-60℃ for 45s and 72℃ for 1 min;with a final cycle of 72℃ for 10 min (Snejana et al., 2008; Yang et al., 2004) |
| 5'-AGAGCGACACCCTAGAC-3' | |||
| Osteopontin | S: 5'-CAGTGACCAGTTCATCAGATTCATC-3' | 347 | |
| A: 5'-CTAGGCATCACCTGTGCCATACC-3' | |||
| Collagenase type Ⅰ(Col Ⅰ) | S: 5'-CCCCCTCCCCAGCCACAAAGA-3' | 360 | |
| A: 5'-TCTTGGTCGGTGGTGGACTCT-3' | |||
| Alkaline phosphatase (ALP) | S: 5'-TGGAGCTTCAGAAGCTCAACACCA-3' | 453 | |
| A: 5'-ATCTCGTTGTCTGAGTACCAGTCC-3' | |||
| β-Actin | S: 5'-TCTGGCACCACACCTTCTACAATGAGCTGCG-3' | 838 | |
| A: 5'-CGTCATACTCCTGCTTGCTGATCCACATCTGC-3' |
4.骨髓间充质干细胞/基质细胞(MSCs)的完整工作流程
间充质干细胞( MSCs)可从各种组织中分离得到,如骨髓,脂肪,脐带等。扩增的MSCs具有归巢、免疫调节、促进修复和直接重建受损组织的能力,因此,MSCs被认为是有极大潜力用于治疗多种疾病的细胞来源。Miltenyi Biotec-直致力于开发各类产品,以推进MSCs的基础和临床应用研究。
本文针对来源于骨髓、脂肪组织和脐带的MSCs,我们总结了MSCs研究的所有步骤,包括标准化的MSCs检测和定量、用无外源动物源成份、无血清的培养基进行高效地体外扩增,以及MSCs功能分析等(如细胞分化和免疫调节)。

| 1.使用MSC Enumeration kit,huaman 试剂盒对骨髓样品进行质量控制 |
用流式方法对新鲜骨髓抽取物( BMA)来源的MSCs进行标准化的鉴定和定量
- 每次检测仅需200pl骨髓样品
- 整个过程仅需30分钟
试剂盒包含:
- 3种荧光素标记的抗体混合物,包括MSCs特征性标记物CD271 (LNGFR)和非MSCs标记物CD45和CD235a
- 额外的MSCs标记物MSCA-1( W882),用于鉴定具有高增殖潜能的MSCs
- 四种荧光标记的同型对照抗体混合物
- 细胞活性检测试剂:7-AAD
- 用于去除红细胞的红细胞裂解液
- FcR阻断试剂.用于阻断非特异性结合
搭配使用MAcsouant~流式细胞仪,可以实现自动化和精确的细胞计数。
| 产品 | 货号 |
| MSC Enumeration kit,huaman | 130-106-646 |
| 2.MSCs的富集:MSC磁性细胞分选 |
- CD271 (LNGFR) MicroBead Kit,human:
分选得到高纯度、高活性的CD271+ MSCs;
- Anti-MSCA-1 (W882) MicroBead Kit,human:
用高度特异性的标记物分选得到具有高增殖潜能的MSCs;
- 快速简便,只需1小时。
搭配使用autoMACS Pro磁性细胞分选仪,能够实现自动化的分选。
| 产品 | 货号 |
| CD271 MicroBead Kit, human | 130-099-023 |
| Anti-MSCA-1 (W882) MicroBead Kit,human | 130-093-583 |
| 3.MSCs高效扩增:StemMACS™ MSC Expansion Media Kit XF, human, |
- 高效扩增人MSCs;
- 不合异源动物源成份、不合血清;
- 培养皿无需预包被;
- 无需额外的添加剂、生长因子或血清;
- 保留完好的分化潜能和免疫调节能力;
为兼容临床转化应用,美天旎提供GMP级细胞培养基。
| 产品 | 货号 |
| StemMACS MSC Expansion Media Kit XF, human | 130-104-182 |
| 4.MSCs表型鉴定:MSC Phenotyping Kit, human |
- 通过流式分析对体外培养的MSCs进行标准化的鉴定和定量;
- 严格参照ISCT标准;
- 仅需30分钟;
试剂盒包含:
- 七种荧光素标记的抗体混合物,包括MSCs特征性标记物:CD73、CD90和CD105.以及非MSCs标记物:CD14、CD20、CD34和CD45
- 5种荧光素标记的同型对照抗体混合物
- 用于PerCP、PE、APC和FITC通道调节补偿的5种补充性抗体
与MAcsouant~流式细胞仪搭配使用,可以实现自动化和精确的细胞计数。
| 产品 | 货号 |
| MSC Phenotyping Kit, human | 130-125-285 |
| 5.MSCs细胞分化潜能分析:StemMACS™ OsteoDiff Media, human,StemMACS™ AdipoDiff Media, human,StemMACS™ ChondroDiff Media, human |
- 支持MSC分化为脂肪细胞、成骨细胞和软骨细胞;
- 适用于扩增后的MSCs的分化能力分析或质控;
- 适用于MSC分化过程的体外研究,包括基因表达和蛋白质分析。
| 产品 | 货号 |
| StemMACS OsteoDiff. human | 130-091-678 |
| StemMACS AdipoDiff, human | 130-091-677 |
| StemMACS ChondroDiff.human | 130-091-679 |
| 6.MSCs免疫调节功能分析:MSC Suppression Inspector Kit, human |
- 标准化的功能检测:通过与CD4+CD25-或CD4+responder T cells(Tresp)进行共培养,检测MSCs的免疫调节功能
- 使用预加载了生物素化的CD2、CD3和CD28抗体的Anti-Biotin MACSiBeadTM Particles,获得最佳的T细胞刺激效果
- 详细的研究方案,通过3H-胸苷掺入实验和CFSE染色检测包括Tresp细胞的分选/刺激、MSCs抑制和Tresp细胞增殖的效果
| 产品 | 货号 |
| MSC Suppression Inspector, human | 130-096-207 |
| StemMACS MSC Expansion Media Kit XF, human | 130-104-182 |
| CD4+CD25+ Regulatory T Cell lsolation Kit, human | 130-091-301 |
| CD4+CD25+CD127 lowRegulatory T Cell lsolation kit,human | 130-094-775 |
5.间充质干细胞(MSC)免疫抑制功能检测
间充质干细胞(MSC)是一群可贴壁、形态类似于成纤维细胞、具有生成成纤维细胞集落形成单位(CFU-F)以及分化为成骨细胞,脂肪细胞和成软骨细胞的潜能的一群异质性细胞群,其存在十分广泛,可存在于骨髓、脂肪、脐带、牙周、滑膜、胎盘、尿液等各种组织。
临床上常利用MSC可分化成成骨、软骨和脂肪的特性进行骨修复,治疗成骨不全、软骨损伤、肌无力、股骨头坏死、心肌梗塞、、糖尿病、帕金森综合症等疾病。另外,由于MSC具有调节免疫应答的能力,大大增加MSC在治疗应用中的价值。MSC可以根据微环境,通过抑制T细胞、B细胞、DC细胞、NK细胞,从而释放抑制因子、刺激因子或表达其它表面分子来发挥其免疫调节功能。研究人员还发现,无血清条件下培养的MSC比传统的含血清培养基培养的MSC对免疫细胞的免疫抑制作用更大。
MSC对免疫细胞的抑制:
| 免疫调控功能检测类别 | 试验 | 待测细胞 | 靶细胞 | 刺激因素 | 检测指标和参数 |
| MSC与免疫细胞相互作用 | 总淋巴细胞增殖 | MSC | PBMC(CFSE) T细胞(CFSE) PBMC |
PHA anti-CD3/anti-CD28 同种异体PBMC |
流式检测淋巴细胞增殖抑制率 |
| 淋巴细胞活化 | MSC | PBMC T细胞 |
PHA anti-CD3/anti-CD28 LPS |
检测细胞因子释放IL10/IFN-γ T细胞活化表面分子表达,CD25, CD154, CD69 |
|
| Th1淋巴细胞亚群 | MSC | PBMC T细胞 |
PMA/ionomycin/BFA PHA anti-CD3, anti-CD28 |
流式检测CD3+CD8-IFN-γ+细胞比例 | |
| Th2淋巴细胞亚群 | MSC | PBMC T细胞 |
PMA/ionomycin/BFA PHA anti-CD3, anti-CD28 |
流式检测CD3+CD8-IL4+细胞比例 | |
| Th17淋巴细胞亚群 | MSC | PBMC T细胞 |
PMA/ionomycin/BFA PHA anti-CD3, anti-CD28 |
流式检测CD3+CD8-IL-17A+细胞比例 | |
| Treg淋巴细胞亚群 | MSC | PBMC T细胞 |
/ | 流式检测CD4+CD25+FoxP3+血细胞比例 | |
| PHA/IL-2 | 流式检测CD4+CD25+CD127+血细胞比例 | ||||
| MSC调控免疫细胞释放炎症因子评价 | 免疫细胞分泌因子检测 | MSC | PBMC | PHA conA 异体PBMC |
上清中TNF-α, IFN-γ, IL-4, IL-10, IL-6, IL-8, IL-17A检测 |
| MSC表达免疫活性分子功能评价 | hMSCs分泌因子检测 | MSC | 促炎性细胞因子 IFN-γ, TNF-α, IL-1β |
上清中IDO1, PGE2, HGF, IL-10, IL-6检测细胞表面PD-L1表达检测 | |
MSC的免疫抑制检测:

主要材料和试剂
Sepmtube -15(PBM, #601115);淋巴细胞分离液(#LSB1077);D-PBS(PBM,#201054);HapCult 人间充质干细胞培养基(PBM, #637050);RPMI 1640(#609043);FBS(#FBS141);L-谷氨酰胺(#214050);丝裂霉素(PBM,#216010);胰蛋白酶 0.25%-EDTA(PBM,#607025);CFSE(PBM, #230850)、 0.5mM EDTA(PBM, #205010)、 CD3功能抗体(eBioscience,#AH1003125);CD28功能抗体(eBioscience,#AH1028125);anti-human CD3 流式抗体(eBioscience)
实验步骤
1. 分离PBMC
1) 将淋巴细胞分离液通过隔板中心的孔注入 SepTube®管。注入分离液的体积请参考下表。

2) 抗凝血用等体积 D-PBS 稀释,混合均匀。如:5 mL 抗凝血用 5 mL D-PBS 稀释。
3) 保持 SepTube®管垂直,通过血清移液管将稀释的样品沿管壁加入管中。样品将会和隔板上 方的分离液混合,但不会影响分离效果。
注:样品也可以直接倒入 SepTube®管中,但要小心避免样品通过隔板中央的小孔直接进入隔板 下方的分离液中。
4) 在开启离心机制动器的情况下,室温 1200×g 离心 10 分钟。
注:如果样品在体外超过 24h 以上,建议离心 20 分钟以上。
离心力(g)和转速(rpm)转换公式:

注:rpm:每分钟转速;RCF:相对离心力;Radius:离心机转子半径(cm)
5) 离心完成后,可以将最上层不含细胞的 D-PBS 稀释液吸出弃掉,或者直接将包含 MNCs 的上层稀释液直接倒入新的无菌离心管中。请勿倒置 SepTube®管超过 2 秒,以免底层红细 胞倒出。
注:离心后,SepTube®隔板上表面可能存在少量红细胞,但这些少量的红细胞不会影响下游实 验和细胞分离效果。如果 SepTube®隔板上表面发现有较多的红细胞,可能是由于采血时间较长 引起的,此时可以继续 1200×g 离心 10 分钟,以减少红细胞的残留。
6) 向分离的 MNCs 中添加 0.5-1 倍体积 D-PBS (2μM EDTA) + 2% FBS,室温 300×g 离心 8 分钟洗涤细胞。 注:为去除分离 MNCs 中的血小板,可以关闭离心机制动器,室温 120×g 离心 10 分钟洗涤 MNCs。
7) 使用冻存液重悬 PBMC,使其浓度达到 5~10×106 细胞/mL,分装到冻存管中-80℃梯度降 温冻存备用。
2. MSC与PBMC(T细胞)共培养
-1 Day:
1) 在共培养 MSC 和 PBMC 之前,提前一天用 10 μg /mL 丝裂霉素 C(#216010)在 37℃条件 下处理 MSC 2h;(3ml/皿,φ100mm )
注:丝裂霉素抑制细胞增殖,但仍能保持细胞分泌因子的能力。
2) 丝裂霉素处理后的 MSC 细胞,用 D-PBS 2ml/孔洗涤三次;
3)然后用胰酶消化细胞,用含血清的培养基终止胰酶消化作用,收集并计数细胞;
4) 1200rpm 离心 8 分钟收集细胞,去除离心后的上清液;
5) 根据计数的细胞数,添加相应体积的 MSC 培养基重悬细胞,使得的细胞浓度为:1×105/mL。
6) 将 1 mL 浓度为 1× 105/mL 灭活的 MSC 接种在 24 孔板中,待第二天完全贴壁后备用;
0 Day:
7) 准备 CFSE 标记的 PBMC:
a) 37℃水浴复苏冻存的 PBMC,室温或者水浴预温的 D-PBS 重悬复苏的细胞,1200rpm 8 分钟离心洗涤细胞两次,去除血清和冻存液;
b) 弃上清,细胞以 5-10×106的细胞密度,在室温条件下用含 1μM CFSE 的 D-PBS 避 光孵育 10 分钟,标记 PBMC;
c) 用预冷的完全培养基(RPMI 1640 +10% FBS, 2 mM L-谷氨酰胺) 以 5×体积稀释标记的 PBMC,4℃静置 5 分钟,终止 CFSE 的细胞标记;
d) 标记后的细胞用完全培养基 1200rpm 8 分钟离心洗涤 3 次,彻底去除残留的 CFSE;
e) CFSE 标记后 PBMC 用完全培养基重悬。
8) 吸出 MSC 培养基,用 D-PBS 洗涤 2 次,并迅速加入标记的 PBMC, 按照 1:5 (MSC:PBMC) 比例接种 PBMC(5×105/孔, 24 孔板);
9) 在 PBMC 刺激孔中加入 CD3 功能抗体(5-10 μg/mL)、CD28 功能抗体(2 μg/ml)和 hIL2 (50ng/ml)进行刺激;
10) 细胞共培养 5 天后,收集悬浮细胞,并用 anti-human CD3 流式抗体标记细胞,进行细胞增殖分析
![]()

6.骨髓来源的抑制细胞(MDSC)流式的流程
- 确定细胞数。
- 将细胞悬液以300×g离心10分钟。 完全吸出上清液。
- 将细胞重悬,每86 µL缓冲液最多可容纳106个有核细胞。 将每种抗体2 µL加入混合物中。
- 悬浮细胞在黑暗中于冰箱中(2-8°C)孵育10分钟。
- 通过添加1-2 mL缓冲液洗涤细胞,并以300×g离心10分钟。 上清液被完全吸出。
- 将细胞重悬于100 µL缓冲液中,并在立即在MACSQuant®Analyzer 10中采集样品之前添加1 µL 7-AAD。

靶标 |
克隆号 |
荧光 |
货号 |
CD45 |
HI30 |
eFluor 506 |
69-0459-42 |
CD11b |
CBRM1/5 |
Super Bright 436 |
62-0113-42 |
HLA-DR |
LN3 |
FITC |
11-9956-42 |
CD33 |
HIM3-4 |
PE |
12-0339-42 |
CD16 |
eBioCB16 (CB16) |
PE-Cyanine7 |
25-0168-42 |
CD14 |
61D3 |
APC-eFluor 780 |
47-0149-42 |
LOX-1 |
- |
- |
NV-PA5109203 |
7.MSC助力新冠SARS-Cov2肺炎研究
MSC初认识
|
间充质干细胞(MSC)最初在骨髓中发现,具有自我更新和多谱系分化能力,在体外可被诱导成脂肪细胞、骨细胞、软骨细胞、心肌细胞、神经细胞等,可作为理想的种子细胞用于衰老和病变引起的组织器官损伤修复。MSC还具有免疫调节功能。该细胞表达CD90、CD105、CD73但是不表达CD34、CD45、HLA-DR等。 间充质干细胞(MSCs)在病毒性肺炎治疗中,可能存在的机制:一方面可以通过调节免疫反应,抑制细胞因子风暴对人体多器官造成的损害;另一方面,干细胞在通过静脉输注进入人体后,部分聚集在肺部,可能改善肺部细胞微环境、保护肺泡上皮细胞、改善肺功能。
|
MSC无血清培养的必要性
|
临床转化医学研究上,MSC已经被用于治疗肝硬化、脊髓损伤、肌萎缩侧索硬化症、修复创伤组织器官、调节免疫等。大量的研究数据表明,MSC治疗是安全可靠有效的,但是,输入MSC后,也会出现发烧现象,部分研究人员推测可能的原因与输入了异体的MSC引起的急性炎症反应有关。但另外一部分研究人员则认为,MSC具有低免疫原性,而且有“免疫豁免”的特性,所以难于引起免疫排斥反应。他们认为“发烧”这一现象可能是因输入的MSC残留了胎牛血清(FBS)成份或DMSO所致,与MSC细胞本身没有关系,但目前还尚未形成定论。考虑到FBS中存在大量的异种蛋白,且血清中还带有潜在病源污染,因此必须降低血清残留量和二甲基亚砜含量,从而减少MSCs治疗引起的不良反应。因此有必要使用无血清的MSC培养基避免不良反应的产生。 |
MSC研究完整解决方案

MSC研究相关产品
|
应用 |
货号 |
名称 |
|
原代细胞 |
人脐带MSC原代细胞1×106 |
|
|
人脐带MSC原代细胞5×105 |
||
|
MSC分离 |
分选磁极5mL |
|
|
352058 |
5mL流式管 |
|
|
淋巴细胞分离液 |
||
|
15ml 密度梯度离心管 |
||
|
1X RBC红细胞裂解缓冲液 |
||
|
EasySep 人CD271 正选试剂盒‖ |
||
|
RosetteSep人 MSC免疫密度梯度离心分选试剂盒, 10mL |
||
|
细胞扩增 |
MesenCult-hPL 培养试剂盒 |
|
|
MesenCult-ACF Plus培养试剂盒 |
||
|
MesenCult-ACF Plus 培养试剂盒 |
||
|
MesenCult-ACF 细胞解离试剂盒 |
||
|
L-谷氨酰胺 |
||
|
Human血小板裂解物 |
||
|
流式检测pane及同型对照 |
人 CD90 (EBIO5E10) PerCP-Cy5.5抗体 |
|
|
小鼠 IgG1 kappa 同型, PerCP-Cy5.5 |
||
|
人CD73 (AD2) PE 抗体 |
||
|
小鼠IgG1 kappa 同型 ,PE |
||
|
人CD105 (ENDOGLIN)(SN6) Pe-Cy7抗体 |
||
|
小鼠IgG1 kappa 同型 , PE-Cy7 |
||
|
人CD45 (HI30) FITC抗体 |
||
|
小鼠 IgG1 kappa 同型, FITC |
||
|
人 HLA-DR (LN3) APC抗体 |
||
|
小鼠 IgG2b kappa 同型, APC |
||
|
人 CD34 4H11 SB600 抗体 |
||
|
小鼠IgG1 kappa 同型 , SB600 |
||
|
成脂分化染色 |
MesenCult成脂分化试剂盒 |
|
|
O1516 |
油红O |
|
|
成骨分化染色 |
MesenCult 成骨分化试剂盒 |
|
|
A5533 |
茜素红S |
|
|
软骨分化染色 |
MesenCult-ACF 软骨分化试剂盒 |
|
|
89640 |
甲苯胺蓝 |
|
|
MSC免疫调节功能检测 |
ImunoSep人 T细胞富集试剂盒 |
|
|
EasySep人 T细胞富集试剂盒 |
||
|
脐带血CD3 T细胞 |
||
|
CFSE |
||
|
人CD3 (OKT3) 功能抗体 |
||
|
人CD28 (CD28.2) 功能抗体 |
||
|
台盼蓝 |
||
|
碘化丙啶PI |
||
|
细胞冻存 |
Cryostor CS10 |
|
|
MesenCult-ACFMSC专用冻存液 |
8.间充质干细胞(MSC)的分离
分离脂肪组织MSC

主要材料和试剂
|
货号 |
名称 |
|
15-1040 |
40µm滤网 |
|
15-1100 |
100µm滤网 |
实验步骤
1. 添加2-4mL的0.25% I型胶原酶到脂肪组织,用刀片将脂肪组织切成很细小的组织块,放入50mL离心管中。
2. 每cm3组织中加入5mL 0.25% I型胶原酶消,37℃水浴消化1小时。(比如3cm3的组织加入15mL胶原酶)
3. 将样品直立放置5分钟使得脂肪层与水层产生分层。
4. 用吸管取出上面脂肪层。
5. 添加含有2mM EDTA的PBS至终体积50mL。
6. 以转速为300 x g离心10min,离心机降速可以调高(使用brake on)。
7. 弃上清,并用MSC完全培养基重悬细胞。
8. 过滤网。
9. 用台盼蓝拒染。
分离骨髓样本
主要材料和试剂
|
货号 |
名称 |
实验步骤
1. 将淋巴细胞分离液通过隔板中心的孔注入SepTube®管。注入分离液的体积请参考下表。
|
SepTube® |
起始样本体积(mL) |
密度梯度分离液(mL) |
|
15 |
0.5-5 |
4.5 |
|
50 |
4-17 |
15 |
2. 抗凝血用等体积D-PBS稀释,混合均匀。如:5 mL抗凝血用5 mL D-PBS稀释。
3. 保持SepTube®管垂直,通过血清移液管将稀释的样品沿管壁加入管中。样品将会和隔板上方的分离液混合,但不会影响分离效果。
注意:样品也可以直接倒入SepTube®管中,但要小心避免样品通过隔板中央的小孔直接进入隔板下方的分离液中。
4. 在开启离心机制动器的情况下,室温1200×g离心10分钟。
注意:如果样品在体外超过24h以上,建议离心20分钟以上。离心力(g)和转速(rpm)转换公式:

注意:rpm:每分钟转速;RCF:相对离心力;Radius:离心机转子半径(cm)
5. 离心完成后,可以将最上层不含细胞的D-PBS稀释液吸出弃掉,或者直接将包含MNCs的上层稀释液直接倒入新的无菌离心管中。请勿倒置SepTube®管超过2秒,以免底层红细胞倒出。
注意:离心后,SepTube®隔板上表面可能存在少量红细胞,但这些少量的红细胞不会影响下游实验和细胞分离效果。如果SepTube®隔板上表面发现有较多的红细胞,可能是由于采血时间较长引起的,此时可以继续1200×g离心10分钟,以减少红细胞的残留。
6. 向分离的MNCs中添加0.5-1倍体积D-PBS (2μM EDTA) + 2% FBS,室温300×g离心8分钟洗涤细胞。
注意:为去除分离MNCs中的血小板,可以关闭离心机制动器,室温120×g离心10分钟洗涤MNCs。
分离脐带组织MSC
主要材料和试剂
|
货号 |
名称 |
|
3289 |
培养瓶,25cm2,透气盖,CellBIND表面,灭菌,20个/包,10包/箱 |
|
3290 |
培养瓶,75cm2,透气盖,CellBIND表面,灭菌,5个/包,20包/箱 |
|
717805 |
改进Neubauer型 血细胞计数板 |
3.3.2实验步骤
1. 医用镊子将脐带采集瓶中取出,放入烧杯中浸泡清洗。
2. 镊子取出脐带放入大号培养皿,用手术刀切除两侧手术线结扎及淤血部分。
3. 用含双抗PBS对剩余组织在余下的两个烧杯中进行充分清洗,一般冲洗两遍,去除血污。
4. 将清洗干净的脐带置于另一个大号培养皿中,均分为4-5部分,平均每部分约长3-4 cm。
5. 对每一部分沿纵向进行分离,使脐带组织管状变为片状。
6. 将片状脐带组织进行进一步的分离,切割为大小均一的组织块。
7. 使用吸管将组织块逐一种植入预先用DMEM/F12+20% FBS培养基包被好的T-75 cm2培养瓶内,密度20-25块/瓶为宜。
8. 正向置于37℃, 5% CO2培养箱中。
9. 每24小时补加1mL培养基,72小时后全量换液。每周换液两次。

9.MSC研究技术路线
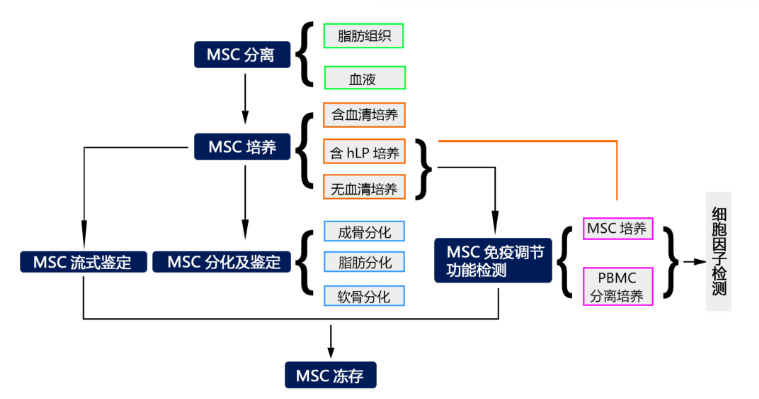
1. MSC的培养



2.MSC流式鉴定
3.MSC分化
4.MSC免疫抑制功能检测

流式检测:
Th1:CD3+CD8-INF-γ+
Th17:CD3+CD8-IL-17+
Treg:CD4+CD25+FoxP3+
Th1增殖抑制率=(实验组-空白组)/(阴性对照组-空白组)
Th17增殖抑制率=(实验组-空白组)/(阴性对照组-空白组)
Treg增殖促进率=(实验组-空白组)/(阴性对照组-空白组)
10.间充质干细胞标志物

间充质干细胞(MSC)是多潜能细胞,可以分化成许多细胞类型,包括骨骼、脂肪、软骨、 肌肉和皮肤。MSC最初是从骨髓样本中分离出来的,但最近它们已经在许多其他类型的组织中被发现,生成一个具有高分化可能性的异质且丰富的细胞群。
| 靶点类型 | 靶点 | 货号 |
|---|---|---|
| MSC-阳性标记物 | CD105 | RM5704 |
| RM3604 | ||
| Q10379 | ||
| CD36 | PA116813 | |
| MA516941 | ||
| MA514112 | ||
| MA119407 | ||
| CD44 | RM5704 | |
| MHCD4401 | ||
| MA513890 | ||
| MA512394 | ||
| 710413 | ||
| 701406 |
| 靶点类型 | 靶点 | 货号 |
|---|---|---|
| MSC-阳性标记物 | CD73 | MA515537 |
| 410200 | ||
| CD90 (Thy-1) | MA517752 | |
| MA517747 | ||
| MA516683 | ||
| Nestin | MA1110 | |
| MSC-阴性标记物 | CD11b | PA579533 |
| MA528264 | ||
| CD14 | MHCD1400 | |
| CD19 | MHCD10500 | |
| CD34 | RM3604 | |
| CD3458101 | ||
| CD79a | MA515234 | |
| MA514556 | ||
| MA513212 | ||
| HLA-DR | MA511966 |
11. MSCs 对淋巴细胞增殖抑制检测
间充质干细胞(MSC)是一群可贴壁、形态类似于成纤维细胞、具有生成成纤维细胞集落形成单位(CFU-F)以及分化为成骨细胞,脂肪细胞和成软骨细胞的潜能的一群异质性细胞群,其存在十分广泛,可存在于骨髓、脂肪、脐带、牙周、滑膜、胎盘、尿液等各种组织。
临床上常利用MSC可分化成成骨、软骨和脂肪的特性进行骨修复,治疗成骨不全、软骨损伤、肌无力、股骨头坏死、心肌梗塞、、糖尿病、帕金森综合症等疾病。另外,由于MSC具有调节免疫应答的能力,大大增加MSC在治疗应用中的价值。MSC可以根据微环境,通过抑制T细胞、B细胞、DC细胞、NK细胞,从而释放抑制因子、刺激因子或表达其它表面分子来发挥其免疫调节功能。研究人员还发现,无血清条件下培养的MSC比传统的含血清培养基培养的MSC对免疫细胞的免疫抑制作用更大。

MSC对免疫细胞的抑制:
| 免疫调控功能检测类别 | 试验 | 待测细胞 | 靶细胞 | 刺激因素 | 检测指标和参数 |
| MSC与免疫细胞相互作用 | 总淋巴细胞增殖 | MSC | PBMC (CFSE) T细胞(CFSE) PBMC |
PHA anti-CD3/anti-CD28 同种异体PBMC |
流式检测淋巴细胞增殖抑制率 |
| 淋巴细胞活化 | MSC | PBMC T细胞 |
PHA anti-CD3/anti-CD28 LPS |
检测细胞因子释放IL10/IFN-γ T细胞活化表面分子表达,CD25, CD154, CD69 |
|
| Th1淋巴细胞亚群 | MSC | PBMC T细胞 |
PMA/ionomycin/BFA PHA anti-CD3, anti-CD28 |
流式检测CD3+CD8-IFN-γ+细胞比例 | |
| Th2淋巴细胞亚群 | MSC | PBMC T细胞 |
PMA/ionomycin/BFA PHA anti-CD3, anti-CD28 |
流式检测CD3+CD8-IL4+细胞比例 | |
| Th17淋巴细胞亚群 | MSC | PBMC T细胞 |
PMA/ionomycin/BFA PHA anti-CD3, anti-CD28 |
流式检测CD3+CD8-IL-17A+细胞比例 | |
| Treg淋巴细胞亚群 | MSC | PBMC T细胞 |
/ | 流式检测CD4+CD25+FoxP3+血细胞比例 | |
| PHA/IL-2 | 流式检测CD4+CD25+CD127+血细胞比例 | ||||
| MSC调控免疫细胞释放炎症因子评价 | 免疫细胞分泌因子检测 | MSC | PBMC | PHA conA 异体PBMC |
上清中TNF-α, IFN-γ, IL-4, IL-10, IL-6, IL-8, IL-17A检测 |
| MSC表达免疫活性分子功能评价 | hMSCs分泌因子检测 | MSC | 促炎性细胞因子 IFN-γ, TNF-α, IL-1β |
上清中IDO1, PGE2, HGF, IL-10, IL-6检测细胞表面PD-L1表达检测 | |
MSC的免疫抑制检测:
& 主要材料和试剂:
HapCult 人间充质干细胞培养基(PBM, #637050);
CD3功能抗体(eBioscience,#16-0037-38);
CD28功能抗体(eBioscience,#16-0289-85);
& 实验步骤:
(一)分离PBMC
| SepTube™密度梯度离心管 | ImunoSep™密度梯度细胞分离液(mL) | 稀释的抗凝血样本体积(mL) |
| SepTube™-15 | 4.5 | 1-10 |
| SepTube™-50 | 15 | 8-34 |
为取得较好的 MNCs 分离效果,请确保 ImunoSep™细胞分选液(#604050)、ImunoSep™密度梯度细胞分离液(#LSB1077)和离心机在室温(15-25℃)状态下。
1. 用等体积 ImunoSep™细胞分选液(#604050)稀释抗凝血,混合均匀。如:5 mL 抗凝血用 5 mL ImunoSep™细胞分选液(#604050)稀释。
2. 将 ImunoSep™密度梯度细胞分离液(#LSB1077)通过隔板中心的孔注入 SepTube™密度梯度离心管 (如上图 1①)。注入分离液的体积请参考下表。
3. 保持 SepTube™密度梯度离心管垂直,通过血清移液管将稀释的样品沿管壁加入管中(如上图 1②)。 样品将会和隔板上方的分离液混合,但不会影响分离效果。
注:样品也可以直接倒入SepTube®管中,但要小心避免样品通过隔板中央的小孔直接进入隔板下方的分离液中。
4. 水平转子离心机,在开启离心机制动器的情况下,室温1200×g离心10分钟。
注:如果样品在体外超过24h以上,建议离心20分钟以上。
离心力(g)和转速(rpm)转换公式:
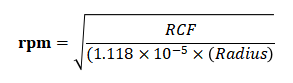
注:rpm:每分钟转速;RCF:相对离心力;Radius:离心机转子半径(cm)
5. 离心完成后,将隔板上方包含MNCs和血浆的混合液直接倒入新的离心管中。
注:请勿倒置SepTube™密度梯度离心管超过2秒,以免倒出底层红细胞与粒细胞。
注:离心后,SepTube™密度梯度离心管隔板上表面可能存在少量红细胞,但这些少量的红细胞不会影响下游实验。如果SepTube™密度梯度离心管隔板上表面发现有较多的红细胞,可能是由于采血时间较长引起的,此时可以继续1200×g离心10分钟,以减少红细胞的残留。
6. 在MNCs离心管中添加5-1倍体积ImunoSep™细胞分选液(#604050),室温300×g离心8分钟洗涤细胞。
7. 弃上清。
8. 重复步骤6)和7)。
9. 重悬细胞备用。
(二)MSC的培养
待检测MSC的培养(需要使用检测的MSC培养基)
脐带MSC的培养
(三)MSC与PBMC共培养
-1 Day:
1. 在共培养MSC和PBMC之前,提前一天用丝裂霉素C在37℃条件下处理MSC 2h;(3ml/皿,φ100mm )
注:丝裂霉素抑制细胞增殖,但仍能保持细胞分泌因子的能力。
2. 丝裂霉素处理后的MSC细胞,用HapClut™ D-PBS 2ml/孔洗涤三次;
3. 然后用胰酶消化细胞,用含血清的培养基终止胰酶消化作用,收集并计数细胞;
4. 1200rpm离心8分钟收集细胞,去除离心后的上清液;
5. 根据计数的细胞数,添加相应体积的MSC培养基重悬细胞,使得的细胞浓度为1×105/mL。
6. 将1 mL浓度为1× 105/mL灭活的MSC接种在24孔板中,待第二天完全贴壁后备用;
0 Day:
7.准备CFSE标记的PBMC:
a.37℃水浴复苏冻存的PBMC,室温或者水浴预温的HapClut™ D-PBS重悬复苏的细胞,离心洗涤细胞两次,去除血清和冻存液;
b.弃上清,细胞以5-10×106的细胞密度,在室温条件下用含CFSE的HapClut™ D-PBS避光孵育10分钟,标记PBMC;
c. 用预冷的完全培养基以5×体积稀释标记的PBMC,4℃静置5分钟,终止CFSE的细胞标记;
d. 标记后的细胞用完全培养基1200rpm 8分钟离心洗涤3次,彻底去除残留的CFSE;
e. CFSE标记后PBMC用完全培养基重悬。
8. 吸出MSC培养基,用HapClut™ D-PBS洗涤,并迅速加入标记的PBMC, 按照不同 (MSC:PBMC)比例接种PBMC(5×105/孔, 24孔板);
9. 在PBMC孔和PBMC+MSC共培养孔加入CD3功能抗体、CD28功能抗体和hIL-2进行刺激;
10. 细胞共培养5天后,收集悬浮细胞,并用anti-human CD3流式抗体标记细胞,进行细胞增殖分析。
淋巴细胞增殖抑制率%=1- 细胞增殖(MSC共培养)/ 细胞增殖(PBMC培养)
12.MSC细胞对Treg 增殖促进效率检测
主要材料和试剂:
SepTube™密度梯度离心管(#601015/601050)、ImunoSep™细胞分选液(#604050)、ImunoSep™密度梯度细胞分离液(#LSB1077)、HapClut™ MSC 人间充质干细胞无血清培养基(#637050)、HapClut™ RPMI 1640(#609043)、FBS(#FBS141)、L-谷氨酰胺(#214010)、胰蛋白酶0.25%-EDTA(#607025)、HapClut™ D-PBS(#201050)、Mitomycin C/丝裂霉素C (#216010)、CFSE(#230850)、anti-human CD3功能让抗体(#AH1003125)、anti-human CD28功能抗体(#AH1028125)、hIL-2(#200-02)、ImunoSep™ CD4 T cell enrichment kit(#710410),Anti-human CD4流式抗体、Anti-human CD25流式抗体、Anti-FoxP3流式抗体、Foxp3/转录因子流式固定破膜缓冲液(#00-5523-00)
实验步骤:
1. 分离PBMC(同第11个实验1中分离PBMC步骤)
2. MSC的培养(同第11个实验2中MSC的培养步骤)
3. MSC与CD4+ 细胞共培养
-1 Day:
1. 在共培养MSC和CD4+T细胞之前,提前一天用10 μg /mL丝裂霉素C在37℃条件下处理MSC 2h;(3ml/皿,φ100mm )
注:丝裂霉素抑制细胞增殖,但仍能保持细胞分泌因子的能力。
2. 丝裂霉素处理后的MSC细胞,用HapClut™ D-PBS2ml/孔洗涤三次;
3. 然后用胰酶消化细胞,用含血清的培养基终止胰酶消化作用,收集并计数细胞;
4. 1200rpm离心8分钟收集细胞,去除离心后的上清液;
5. 根据计数的细胞数,添加相应体积的MSC培养基重悬细胞,使得的细胞浓度为:1×105/mL
6. 将1 mL浓度为1×105/mL灭活的MSC接种在24孔板中,待第二天完全贴壁后备用;
0 Day:
7. 分选CD4+细胞,分选流程参见ImunoSep™ CD4+ T cell enrichment kit(#710410)说明书;
8. 吸出MSC培养基,并用HapClut™ D-PBS洗涤2次,并迅速加入分选的CD4+细胞, 按照1:5 (MSC:CD4+T细胞)比例接种CD4+细胞(1×105 MSC:5×105 CD4+细胞);
9. 在CD4+细胞刺激孔和MSC+CD4细胞孔中加入CD3功能抗体、CD28功能抗体和hIL-2进行刺激;
10. 细胞共培养5天后,收集CD4+细胞,并用anti-human CD4、anti-human CD25流式抗体、Anti-FoxP3流式抗体标记Treg细胞,进行细胞流式分析。
Treg细胞促进率%=Treg细胞%(MSC共培养)/ Treg细胞%(CD4培养)
13.MSC 细胞对 Th1 抑制效率检测(PMA)
主要材料和试剂:
SepTube™密度梯度离心管(#601015/601050)、ImunoSep™细胞分选液(#604050)、ImunoSep™密度梯度细胞分离液(#LSB1077)、HapClut™ MSC 人间充质干细胞无血清培养基(#637050)、HapClut™ RPMI 1640(#609043)、FBS(#FBS141)、L-谷氨酰胺(#214010)、胰蛋白酶0.25%-EDTA(#607025)、HapClut™ D-PBS(#201050)、Mitomycin C/丝裂霉素C (#216010)、CFSE(#230850)、anti-human CD3功能让抗体(#AH1003125)、anti-human CD28功能抗体(#AH1028125)、hIL-2(#200-02)、ImunoSep™ CD4 T cell enrichment kit(#710410),Anti-human CD4流式抗体、Anti-human CD25流式抗体、Anti-FoxP3流式抗体、Foxp3/转录因子流式固定破膜缓冲液(#00-5523-00)、IL-12(#200-12)、anti-human IL-4功能抗体(#16-7048-85)、PMA& Ion刺激剂(#00-4975-03)
检测细胞:CD3+CD8-INFγ+
实验步骤:
- 分离 PBMC(同第11个实验 1 中分离 PBMC 步骤)
- MSC 的培养(同第11个实验 2 中 MSC 的培养步骤)
- MSC 与 CD4+细胞共培养
-1 Day:
1) 在共培养 MSC 和 CD4+T 细胞之前,提前一天用 10 μg /mL 丝裂霉素 C 在 37℃条件下处理MSC 2h;(3ml/皿,φ100mm )
注:丝裂霉素抑制细胞增殖,但仍能保持细胞分泌因子的能力。
2) 丝裂霉素处理后的 MSC 细胞,用 D-PBS 2ml/孔洗涤三次;
3) 然后用胰酶消化细胞,用含血清的培养基终止胰酶消化作用,收集并计数细胞;
4) 1200rpm 离心 8 分钟收集细胞,去除离心后的上清液;
5) 根据计数的细胞数,添加相应体积的 MSC 培养基重悬细胞,使得的细胞浓度为:1×105/mL。
6) 将 1 mL 浓度为 1× 105/mL 灭活的 MSC 接种在 24 孔板中,待第二天完全贴壁后备用;
0 Day:
7) 分选 CD4+细胞,分选流程参见 ImunoSep™ CD4+ T cell enrichment kit(PBM,#710410)说明书。
8) 吸出 MSC 培养基,并用 D-PBS 洗涤 2 次,并迅速加入 CD4+细胞, 按照 1:5 (MSC:CD4+细胞)比例接种 CD4+细胞 (1×105MSC:5×105CD4+细胞);
8) 在 CD4+T 细胞刺激孔中加入 CD3 功能抗体(0.5 μg/mL)、CD28 功能抗体(2 μg/ml)和hIL2 (50ng/ml)进行刺激;还包含:IL-12(20 ng/ml)、anti-human IL-4(10 μg /ml )
9) 细胞共培养 5 天后,加入刺激剂(PMA&Ionomycin),孵育 5 小时。
10) 加入抑制剂(BFA& monensin),收集悬浮细胞,进行流式细胞分析 CD3+CD8-INF-γ+。
11) Th1 细胞抑制率%=1- Th1细胞%(𝑀𝑆𝐶共培养)/Th1细胞%(CD4细胞培养)(流式数据)
14.MSC细胞对Th17抑制效率检测 (PMA)
主要材料和试剂:
SepTube™密度梯度离心管(#601015/601050)、ImunoSep™细胞分选液(#604050)、ImunoSep™密度梯度细胞分离液(#LSB1077)、HapClut™ MSC 人间充质干细胞无血清培养基(#637050)、HapClut™ RPMI 1640(#609043)、FBS(#FBS141)、L-谷氨酰胺(#214010)、胰蛋白酶0.25%-EDTA(#607025)、HapClut™ D-PBS(#201050)、Mitomycin C/丝裂霉素C (#216010)、CFSE(#230850)、anti-human CD3功能让抗体(#AH1003125)、anti-human CD28功能抗体(#AH1028125)、hIL-2(#200-02)、ImunoSep™ CD4 T cell enrichment kit(#710410),Anti-human CD4流式抗体、Anti-human CD25流式抗体、Anti-FoxP3流式抗体、Foxp3/转录因子流式固定破膜缓冲液(#00-5523-00)、IL-12(#200-12)、anti-human IL-4功能抗体(#16-7048-85)、PMA& Ion刺激剂(#00-4975-03)、hIL-6(#200-06)、TGF-β1(#100-21C)、IL-23(#200-23)、IL-1β(#200-01B)、anti-IFN-γ(#AH1029150)、PHA( #00-4977-93)、anti-human CD3,FITC (#AH0103125) 、anti-human CD8a,PE(#AH0208410)、anti-human IL-17,APC (#AH0317110)
检测细胞: CD3+CD8-IL-17+
实验步骤:
1. 分离PBMC和CD4+细胞(同第11个实验1中分离PBMC步骤)
2. MSC的培养(同第11个实验2中MSC的培养步骤)
3. MSC与CD4+细胞共培养
-1 Day:
- 在共培养MSC和CD4 T细胞之前,提前一天用10 μg /mL丝裂霉素C在37℃条件下处理MSC 2h;(3ml/皿,φ100mm )
注:丝裂霉素抑制细胞增殖,但仍能保持细胞分泌因子的能力。
- 丝裂霉素处理后的MSC细胞,用HapClut™ D-PBS2ml/孔洗涤三次;
- 然后用胰酶消化细胞,用含血清的培养基终止胰酶消化作用,收集并计数细胞;
- 1200rpm离心8分钟收集细胞,去除离心后的上清液;
- 根据计数的细胞数,添加相应体积的MSC培养基重悬细胞,使得的细胞浓度为:1×105/mL。
- 将1 mL浓度为1× 105/mL灭活的MSC接种在24孔板中,待第二天完全贴壁后备用;
0 Day:
- 分选CD4+细胞,分选流程参见ImunoSep™ CD4+T cell enrichment kit(PBM,#710410)说明书。
- 吸出MSC培养基,并用HapClut™ D-PBS洗涤2次,并迅速加入CD4+T细胞, 按照1:5 (MSC:CD4+T细胞)比例接种CD4+ T细胞 (1×105 MSC:5×105 CD4+ T细胞);
- 在CD4+T细胞刺激孔和CD4+ T+MSC共培养孔中加入CD3功能抗体(5 μg/mL)、CD28功能抗体(2 μg/ml)、hIL-2 (50ng/ml)、IL-6(30 ng/ml)、TGF-β1 (5 ng/ml)、IL-23 (30ng/ml)、IL-1β(10 ng/ml)、anti-IFN-γ(5 μg/ml )和anti-IL-4(5 μg/ml )刺激。
- 细胞共培养5天后,加入刺激剂(PMA&Ionomycin),孵育5小时。
- 加入抑制剂(BFA& monensin),收集悬浮细胞,并用CD3+CD8-IL-17+标记细胞,进行细胞流式分析
- Th17细胞增殖抑制率%=1- (Th17细胞(MSC共培养)/Th17细胞(CD4+T细胞))%
15.MSC细胞抑制淋巴细胞分泌TNF-α检测
主要材料和试剂:
MSC培养基、完全培养基、胰蛋白酶0.25%-EDTA、丝裂霉素、anti-human CD3功能抗体、anti-human CD28功能抗体、hIL-2、PMA & Ionomycin、Anti-TNF α ELISA kit (MAB11)、anti-TNF α流式抗体等
SepTube™密度梯度离心管(#601015/601050)、ImunoSep™细胞分选液(#604050)、ImunoSep™密度梯度细胞分离液(#LSB1077)、HapClut™ MSC 人间充质干细胞无血清培养基(#637050)、HapClut™ RPMI 1640(#609043)、FBS(#FBS141)、L-谷氨酰胺(#214010)、胰蛋白酶0.25%-EDTA(#607025)、HapClut™ D-PBS(#201050)、Mitomycin C/丝裂霉素C (#216010)、anti-human CD3功能抗体(#AH1003125)、anti-human CD28功能抗体(#AH1028125)、hIL-2(#200-02)、PMA& Ion刺激剂(#00-4975-03)、Foxp3/转录因子流式固定破膜缓冲液(#00-5523-00)、TNF alpha Monoclonal Antibody (MAb11), PE, eBioscience™(#12-7349-82)
实验步骤:
1. 分离PBMC(同第11个实验1中分离PBMC步骤)
2. MSC的培养(同第11个实验2中MSC的培养步骤)
3. MSC与PBMC共培养
-1 Day:
1)在共培养MSC和PBMC之前,提前一天用10 μg /mL丝裂霉素C在37℃条件下处理MSC 2h;(3ml/皿,φ100mm )
注:丝裂霉素抑制细胞增殖,但仍能保持细胞分泌因子的能力。
2)丝裂霉素处理后的MSC细胞,用HapClut™ D-PBS2ml/孔洗涤三次;
3)然后用胰酶消化细胞,用含血清的培养基终止胰酶消化作用,收集并计数细胞;
4)1200rpm离心8分钟收集细胞,去除离心后的上清液;
5)根据计数的细胞数,添加相应体积的MSC培养基重悬细胞,使得的细胞浓度为:1×105
6)将1 mL浓度为1× 105/mL灭活的MSC接种在24孔板中,待第二天完全贴壁后备用;
0 Day:
7)吸出MSC培养基,并用HapClut™ D-PBS洗涤2次,并迅速加入PBMC, 按照1:5 (MSC:PBMC)比例接种PBMC (1×105MSC:5×105 PBMC);
8)在PBMC刺激孔中加入CD3功能抗体(5 μg/mL)、CD28功能抗体(2 μg/ml)和hIL2 (50ng/ml)进行刺激;
9)细胞共培养5天后,加入刺激剂(PMA和Ionomycin),孵育5小时。
10)收集上清,进行ELISA检测。
抑制效率%=1-共培养组TNFα/PBMC对照组TNFα%
注:同一个共培养细胞上清液设置3个复孔检测
1)收集细胞,进行流式检测TNF-α
a)收集样本孔中细胞,台盼蓝染色计数;
b)细胞离心后,去上清,残留液大约100μL,每管加1mL FoxP3固定/破膜工作液,室温避光孵育30min; FoxP3/转录因子染色缓冲液试剂盒(货号:00-5523);
c)每管加入2mL 1X破膜液,500g离心5min,弃上清;
d)在残留的1X破膜液中重悬细胞,倒出上清液后大约残留100μL;
e)向细胞悬液中加入TNF α-PE,避光孵育30min;
f)每管加入2mL 1X破膜液,500g离心5min,弃上清;
g)加入适量的流式细胞染色缓冲液重悬染色的细胞,流式细胞仪分析样本。
抑制效率%=1-共培养组TNFα% / PBMC对照组TNFα%


 MSC的免疫调节
MSC的免疫调节