文章目录
间充质干细胞(MSC)免疫抑制功能检测
MSC可以根据微环境,通过抑制T细胞、B细胞、DC细胞、NK细胞,从而释放抑制因子、刺激因子或表达其它表面分子来发挥其免疫调节功能。研究人员还发现,无血清条件下培养的MSC比传统的含血清培养基培养的MSC对免疫细胞的免疫抑制作用更大。
1. MSCs 对淋巴细胞增殖抑制检测
间充质干细胞(MSC)是一群可贴壁、形态类似于成纤维细胞、具有生成成纤维细胞集落形成单位(CFU-F)以及分化为成骨细胞,脂肪细胞和成软骨细胞的潜能的一群异质性细胞群,其存在十分广泛,可存在于骨髓、脂肪、脐带、牙周、滑膜、胎盘、尿液等各种组织。
临床上常利用MSC可分化成成骨、软骨和脂肪的特性进行骨修复,治疗成骨不全、软骨损伤、肌无力、股骨头坏死、心肌梗塞、、糖尿病、帕金森综合症等疾病。另外,由于MSC具有调节免疫应答的能力,大大增加MSC在治疗应用中的价值。MSC可以根据微环境,通过抑制T细胞、B细胞、DC细胞、NK细胞,从而释放抑制因子、刺激因子或表达其它表面分子来发挥其免疫调节功能。研究人员还发现,无血清条件下培养的MSC比传统的含血清培养基培养的MSC对免疫细胞的免疫抑制作用更大。

MSC对免疫细胞的抑制:
| 免疫调控功能检测类别 | 试验 | 待测细胞 | 靶细胞 | 刺激因素 | 检测指标和参数 |
| MSC与免疫细胞相互作用 | 总淋巴细胞增殖 | MSC | PBMC (CFSE) T细胞(CFSE) PBMC |
PHA anti-CD3/anti-CD28 同种异体PBMC |
流式检测淋巴细胞增殖抑制率 |
| 淋巴细胞活化 | MSC | PBMC T细胞 |
PHA anti-CD3/anti-CD28 LPS |
检测细胞因子释放IL10/IFN-γ T细胞活化表面分子表达,CD25, CD154, CD69 |
|
| Th1淋巴细胞亚群 | MSC | PBMC T细胞 |
PMA/ionomycin/BFA PHA anti-CD3, anti-CD28 |
流式检测CD3+CD8-IFN-γ+细胞比例 | |
| Th2淋巴细胞亚群 | MSC | PBMC T细胞 |
PMA/ionomycin/BFA PHA anti-CD3, anti-CD28 |
流式检测CD3+CD8-IL4+细胞比例 | |
| Th17淋巴细胞亚群 | MSC | PBMC T细胞 |
PMA/ionomycin/BFA PHA anti-CD3, anti-CD28 |
流式检测CD3+CD8-IL-17A+细胞比例 | |
| Treg淋巴细胞亚群 | MSC | PBMC T细胞 |
/ | 流式检测CD4+CD25+FoxP3+血细胞比例 | |
| PHA/IL-2 | 流式检测CD4+CD25+CD127+血细胞比例 | ||||
| MSC调控免疫细胞释放炎症因子评价 | 免疫细胞分泌因子检测 | MSC | PBMC | PHA conA 异体PBMC |
上清中TNF-α, IFN-γ, IL-4, IL-10, IL-6, IL-8, IL-17A检测 |
| MSC表达免疫活性分子功能评价 | hMSCs分泌因子检测 | MSC | 促炎性细胞因子 IFN-γ, TNF-α, IL-1β |
上清中IDO1, PGE2, HGF, IL-10, IL-6检测细胞表面PD-L1表达检测 | |
MSC的免疫抑制检测:
& 主要材料和试剂:
SepTube™密度梯度离心管(#601015/601050)、
ImunoSep™密度梯度细胞分离液(#604050)、
ImunoSep™密度梯度细胞分离液(#LSB1077)、
HapClut™ MSC 人间充质干细胞无血清培养基(#637050)、
HapClut™ RPMI 1640(#609043)、
FBS(#FBS141)、
L-谷氨酰胺(#214010)、
胰蛋白酶0.25%-EDTA(#607025)、
HapClut™ D-PBS(#201050)、
Mitomycin C/丝裂霉素C (#216010)、
HapClut™人T细胞扩增培养基(#661350)、
CFSE(#230850)、
anti-human CD3功能抗体(#AH1003125)、
anti-human CD28功能抗体(#AH1028125)、
hIL-2(#200-02)
& 实验步骤:
(一)分离PBMC
|
SepTube™密度梯度离心管 |
ImunoSep™密度梯度细胞分离液(mL) |
稀释的抗凝血样本体积(mL) |
|
SepTube™-15 |
4.5 |
1-10 |
|
SepTube™-50 |
15 |
8-34 |
为取得较好的 MNCs 分离效果,请确保 ImunoSep™细胞分选液(#604050)、ImunoSep™密度梯度细胞分离液(#LSB1077)和离心机在室温(15-25℃)状态下。
1. 用等体积 ImunoSep™细胞分选液(#604050)稀释抗凝血,混合均匀。如:5 mL 抗凝血用 5 mL ImunoSep™细胞分选液(#604050)稀释。
2. 将 ImunoSep™密度梯度细胞分离液(#LSB1077)通过隔板中心的孔注入 SepTube™密度梯度离心管 (如上图 1①)。注入分离液的体积请参考下表。
3. 保持 SepTube™密度梯度离心管垂直,通过血清移液管将稀释的样品沿管壁加入管中(如上图 1②)。 样品将会和隔板上方的分离液混合,但不会影响分离效果。
注:样品也可以直接倒入SepTube®管中,但要小心避免样品通过隔板中央的小孔直接进入隔板下方的分离液中。
4. 水平转子离心机,在开启离心机制动器的情况下,室温1200×g离心10分钟。
注:如果样品在体外超过24h以上,建议离心20分钟以上。
离心力(g)和转速(rpm)转换公式:
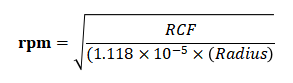
注:rpm:每分钟转速;RCF:相对离心力;Radius:离心机转子半径(cm)
5. 离心完成后,将隔板上方包含MNCs和血浆的混合液直接倒入新的离心管中。
注:请勿倒置SepTube™密度梯度离心管超过2秒,以免倒出底层红细胞与粒细胞。
注:离心后,SepTube™密度梯度离心管隔板上表面可能存在少量红细胞,但这些少量的红细胞不会影响下游实验。如果SepTube™密度梯度离心管隔板上表面发现有较多的红细胞,可能是由于采血时间较长引起的,此时可以继续1200×g离心10分钟,以减少红细胞的残留。
6. 在MNCs离心管中添加5-1倍体积ImunoSep™细胞分选液(#604050),室温300×g离心8分钟洗涤细胞。
7. 弃上清。
8. 重复步骤6)和7)。
9. 重悬细胞备用。
(二)MSC的培养
待检测MSC的培养(需要使用检测的MSC培养基)
脐带MSC的培养
(三)MSC与PBMC共培养
-1 Day:
1. 在共培养MSC和PBMC之前,提前一天用丝裂霉素C在37℃条件下处理MSC 2h;(3ml/皿,φ100mm )
注:丝裂霉素抑制细胞增殖,但仍能保持细胞分泌因子的能力。
2. 丝裂霉素处理后的MSC细胞,用HapClut™ D-PBS 2ml/孔洗涤三次;
3. 然后用胰酶消化细胞,用含血清的培养基终止胰酶消化作用,收集并计数细胞;
4. 1200rpm离心8分钟收集细胞,去除离心后的上清液;
5. 根据计数的细胞数,添加相应体积的MSC培养基重悬细胞,使得的细胞浓度为1×105/mL。
6. 将1 mL浓度为1× 105/mL灭活的MSC接种在24孔板中,待第二天完全贴壁后备用;
0 Day:
7.准备CFSE标记的PBMC:
a.37℃水浴复苏冻存的PBMC,室温或者水浴预温的HapClut™ D-PBS重悬复苏的细胞,离心洗涤细胞两次,去除血清和冻存液;
b.弃上清,细胞以5-10×106的细胞密度,在室温条件下用含CFSE的HapClut™ D-PBS避光孵育10分钟,标记PBMC;
c. 用预冷的完全培养基以5×体积稀释标记的PBMC,4℃静置5分钟,终止CFSE的细胞标记;
d. 标记后的细胞用完全培养基1200rpm 8分钟离心洗涤3次,彻底去除残留的CFSE;
e. CFSE标记后PBMC用完全培养基重悬。
8. 吸出MSC培养基,用HapClut™ D-PBS洗涤,并迅速加入标记的PBMC, 按照不同 (MSC:PBMC)比例接种PBMC(5×105/孔, 24孔板);
9. 在PBMC孔和PBMC+MSC共培养孔加入CD3功能抗体、CD28功能抗体和hIL-2进行刺激;
10. 细胞共培养5天后,收集悬浮细胞,并用anti-human CD3流式抗体标记细胞,进行细胞增殖分析。
淋巴细胞增殖抑制率%=1- 细胞增殖(MSC共培养)/ 细胞增殖(PBMC培养)
2. MSC细胞对Treg 增殖促进效率检测
主要材料和试剂:
SepTube™密度梯度离心管(#601015/601050)、ImunoSep™密度梯度细胞分离液(#604050)、ImunoSep™密度梯度细胞分离液(#LSB1077)、HapClut™ MSC 人间充质干细胞无血清培养基(#637050)、HapClut™ RPMI 1640(#609043)、FBS(#FBS141)、L-谷氨酰胺(#214010)、胰蛋白酶0.25%-EDTA(#607025)、HapClut™ D-PBS(#201050)、Mitomycin C/丝裂霉素C (#216010)、CFSE(#230850)、anti-human CD3功能让抗体(#AH1003125)、anti-human CD28功能抗体(#AH1028125)、hIL-2(#200-02)、ImunoSep™ CD4 T cell enrichment kit(#710410),Anti-human CD4流式抗体、Anti-human CD25流式抗体、Anti-FoxP3流式抗体、Foxp3/转录因子流式固定破膜缓冲液(#00-5523-00)
实验步骤:
1. 分离PBMC(同第一个实验1中分离PBMC步骤)
2. MSC的培养(同第一个实验2中MSC的培养步骤)
3. MSC与CD4+ 细胞共培养
-1 Day:
1. 在共培养MSC和CD4+T细胞之前,提前一天用10 μg /mL丝裂霉素C在37℃条件下处理MSC 2h;(3ml/皿,φ100mm )
注:丝裂霉素抑制细胞增殖,但仍能保持细胞分泌因子的能力。
2. 丝裂霉素处理后的MSC细胞,用HapClut™ D-PBS2ml/孔洗涤三次;
3. 然后用胰酶消化细胞,用含血清的培养基终止胰酶消化作用,收集并计数细胞;
4. 1200rpm离心8分钟收集细胞,去除离心后的上清液;
5. 根据计数的细胞数,添加相应体积的MSC培养基重悬细胞,使得的细胞浓度为:1×105/mL
6. 将1 mL浓度为1×105/mL灭活的MSC接种在24孔板中,待第二天完全贴壁后备用;
0 Day:
7. 分选CD4+细胞,分选流程参见ImunoSep™ CD4+ T cell enrichment kit(#710410)说明书;
8. 吸出MSC培养基,并用HapClut™ D-PBS洗涤2次,并迅速加入分选的CD4+细胞, 按照1:5 (MSC:CD4+T细胞)比例接种CD4+细胞(1×105 MSC:5×105 CD4+细胞);
9. 在CD4+细胞刺激孔和MSC+CD4细胞孔中加入CD3功能抗体、CD28功能抗体和hIL-2进行刺激;
10. 细胞共培养5天后,收集CD4+细胞,并用anti-human CD4、anti-human CD25流式抗体、Anti-FoxP3流式抗体标记Treg细胞,进行细胞流式分析。
Treg细胞促进率%=Treg细胞%(MSC共培养)/ Treg细胞%(CD4培养)
3. MSC 细胞对 Th1 抑制效率检测(PMA)
主要材料和试剂:
SepTube™密度梯度离心管(#601015/601050)、ImunoSep™密度梯度细胞分离液(#604050)、ImunoSep™密度梯度细胞分离液(#LSB1077)、HapClut™ MSC 人间充质干细胞无血清培养基(#637050)、HapClut™ RPMI 1640(#609043)、FBS(#FBS141)、L-谷氨酰胺(#214010)、胰蛋白酶0.25%-EDTA(#607025)、HapClut™ D-PBS(#201050)、Mitomycin C/丝裂霉素C (#216010)、CFSE(#230850)、anti-human CD3功能让抗体(#AH1003125)、anti-human CD28功能抗体(#AH1028125)、hIL-2(#200-02)、ImunoSep™ CD4 T cell enrichment kit(#710410),Anti-human CD4流式抗体、Anti-human CD25流式抗体、Anti-FoxP3流式抗体、Foxp3/转录因子流式固定破膜缓冲液(#00-5523-00)、IL-12(#200-12)、anti-human IL-4功能抗体(#16-7048-85)、PMA& Ion刺激剂(#00-4975-03)
检测细胞:CD3+CD8-INFγ+
实验步骤:
- 分离 PBMC(同第一个实验 1 中分离 PBMC 步骤)
- MSC 的培养(同第一个实验 2 中 MSC 的培养步骤)
- MSC 与 CD4+细胞共培养
-1 Day:
1) 在共培养 MSC 和 CD4+T 细胞之前,提前一天用 10 μg /mL 丝裂霉素 C 在 37℃条件下处理MSC 2h;(3ml/皿,φ100mm )
注:丝裂霉素抑制细胞增殖,但仍能保持细胞分泌因子的能力。
2) 丝裂霉素处理后的 MSC 细胞,用 D-PBS 2ml/孔洗涤三次;
3) 然后用胰酶消化细胞,用含血清的培养基终止胰酶消化作用,收集并计数细胞;
4) 1200rpm 离心 8 分钟收集细胞,去除离心后的上清液;
5) 根据计数的细胞数,添加相应体积的 MSC 培养基重悬细胞,使得的细胞浓度为:1×105/mL。
6) 将 1 mL 浓度为 1× 105/mL 灭活的 MSC 接种在 24 孔板中,待第二天完全贴壁后备用;
0 Day:
7) 分选 CD4+细胞,分选流程参见 ImunoSep™ CD4+ T cell enrichment kit(PBM,#710410)说明书。
8) 吸出 MSC 培养基,并用 D-PBS 洗涤 2 次,并迅速加入 CD4+细胞, 按照 1:5 (MSC:CD4+细胞)比例接种 CD4+细胞 (1×105MSC:5×105CD4+细胞);
8) 在 CD4+T 细胞刺激孔中加入 CD3 功能抗体(0.5 μg/mL)、CD28 功能抗体(2 μg/ml)和hIL2 (50ng/ml)进行刺激;还包含:IL-12(20 ng/ml)、anti-human IL-4(10 μg /ml )
9) 细胞共培养 5 天后,加入刺激剂(PMA&Ionomycin),孵育 5 小时。
10) 加入抑制剂(BFA& monensin),收集悬浮细胞,进行流式细胞分析 CD3+CD8-INF-γ+。
11) Th1 细胞抑制率%=1- Th1细胞%(𝑀𝑆𝐶共培养)/Th1细胞%(CD4细胞培养)(流式数据)
4. MSC细胞对Th17抑制效率检测 (PMA)
主要材料和试剂:
SepTube™密度梯度离心管(#601015/601050)、ImunoSep™密度梯度细胞分离液(#604050)、ImunoSep™密度梯度细胞分离液(#LSB1077)、HapClut™ MSC 人间充质干细胞无血清培养基(#637050)、HapClut™ RPMI 1640(#609043)、FBS(#FBS141)、L-谷氨酰胺(#214010)、胰蛋白酶0.25%-EDTA(#607025)、HapClut™ D-PBS(#201050)、Mitomycin C/丝裂霉素C (#216010)、CFSE(#230850)、anti-human CD3功能让抗体(#AH1003125)、anti-human CD28功能抗体(#AH1028125)、hIL-2(#200-02)、ImunoSep™ CD4 T cell enrichment kit(#710410),Anti-human CD4流式抗体、Anti-human CD25流式抗体、Anti-FoxP3流式抗体、Foxp3/转录因子流式固定破膜缓冲液(#00-5523-00)、IL-12(#200-12)、anti-human IL-4功能抗体(#16-7048-85)、PMA& Ion刺激剂(#00-4975-03)、hIL-6(#200-06)、TGF-β1(#100-21C)、IL-23(#200-23)、IL-1β(#200-01B)、anti-IFN-γ(#AH1029150)、PHA( #00-4977-93)、anti-human CD3,FITC (#AH0103125) 、anti-human CD8a,PE(#AH0208410)、anti-human IL-17,APC (#AH0317110)
检测细胞: CD3+CD8-IL-17+
实验步骤:
1. 分离PBMC和CD4+细胞(同第一个实验1中分离PBMC步骤)
2. MSC的培养(同第一个实验2中MSC的培养步骤)
3. MSC与CD4+细胞共培养
-1 Day:
- 在共培养MSC和CD4 T细胞之前,提前一天用10 μg /mL丝裂霉素C在37℃条件下处理MSC 2h;(3ml/皿,φ100mm )
注:丝裂霉素抑制细胞增殖,但仍能保持细胞分泌因子的能力。
- 丝裂霉素处理后的MSC细胞,用HapClut™ D-PBS2ml/孔洗涤三次;
- 然后用胰酶消化细胞,用含血清的培养基终止胰酶消化作用,收集并计数细胞;
- 1200rpm离心8分钟收集细胞,去除离心后的上清液;
- 根据计数的细胞数,添加相应体积的MSC培养基重悬细胞,使得的细胞浓度为:1×105/mL。
- 将1 mL浓度为1× 105/mL灭活的MSC接种在24孔板中,待第二天完全贴壁后备用;
0 Day:
- 分选CD4+细胞,分选流程参见ImunoSep™ CD4+T cell enrichment kit(PBM,#710410)说明书。
- 吸出MSC培养基,并用HapClut™ D-PBS洗涤2次,并迅速加入CD4+T细胞, 按照1:5 (MSC:CD4+T细胞)比例接种CD4+ T细胞 (1×105 MSC:5×105 CD4+ T细胞);
- 在CD4+T细胞刺激孔和CD4+ T+MSC共培养孔中加入CD3功能抗体(5 μg/mL)、CD28功能抗体(2 μg/ml)、hIL-2 (50ng/ml)、IL-6(30 ng/ml)、TGF-β1 (5 ng/ml)、IL-23 (30ng/ml)、IL-1β(10 ng/ml)、anti-IFN-γ(5 μg/ml )和anti-IL-4(5 μg/ml )刺激。
- 细胞共培养5天后,加入刺激剂(PMA&Ionomycin),孵育5小时。
- 加入抑制剂(BFA& monensin),收集悬浮细胞,并用CD3+CD8-IL-17+标记细胞,进行细胞流式分析
- Th17细胞增殖抑制率%=1- (Th17细胞(MSC共培养)/Th17细胞(CD4+T细胞))%
5. MSC细胞抑制淋巴细胞分泌TNF-α检测
主要材料和试剂:
MSC培养基、完全培养基、胰蛋白酶0.25%-EDTA、丝裂霉素、anti-human CD3功能抗体、anti-human CD28功能抗体、hIL-2、PMA & Ionomycin、Anti-TNF α ELISA kit (MAB11)、anti-TNF α流式抗体等
SepTube™密度梯度离心管(#601015/601050)、ImunoSep™密度梯度细胞分离液(#604050)、ImunoSep™密度梯度细胞分离液(#LSB1077)、HapClut™ MSC 人间充质干细胞无血清培养基(#637050)、HapClut™ RPMI 1640(#609043)、FBS(#FBS141)、L-谷氨酰胺(#214010)、胰蛋白酶0.25%-EDTA(#607025)、HapClut™ D-PBS(#201050)、Mitomycin C/丝裂霉素C (#216010)、anti-human CD3功能抗体(#AH1003125)、anti-human CD28功能抗体(#AH1028125)、hIL-2(#200-02)、PMA& Ion刺激剂(#00-4975-03)、Foxp3/转录因子流式固定破膜缓冲液(#00-5523-00)、TNF alpha Monoclonal Antibody (MAb11), PE, eBioscience™(#12-7349-82)
实验步骤:
1. 分离PBMC(同第一个实验1中分离PBMC步骤)
2. MSC的培养(同第一个实验2中MSC的培养步骤)
3. MSC与PBMC共培养
-1 Day:
1)在共培养MSC和PBMC之前,提前一天用10 μg /mL丝裂霉素C在37℃条件下处理MSC 2h;(3ml/皿,φ100mm )
注:丝裂霉素抑制细胞增殖,但仍能保持细胞分泌因子的能力。
2)丝裂霉素处理后的MSC细胞,用HapClut™ D-PBS2ml/孔洗涤三次;
3)然后用胰酶消化细胞,用含血清的培养基终止胰酶消化作用,收集并计数细胞;
4)1200rpm离心8分钟收集细胞,去除离心后的上清液;
5)根据计数的细胞数,添加相应体积的MSC培养基重悬细胞,使得的细胞浓度为:1×105
6)将1 mL浓度为1× 105/mL灭活的MSC接种在24孔板中,待第二天完全贴壁后备用;
0 Day:
7)吸出MSC培养基,并用HapClut™ D-PBS洗涤2次,并迅速加入PBMC, 按照1:5 (MSC:PBMC)比例接种PBMC (1×105MSC:5×105 PBMC);
8)在PBMC刺激孔中加入CD3功能抗体(5 μg/mL)、CD28功能抗体(2 μg/ml)和hIL2 (50ng/ml)进行刺激;
9)细胞共培养5天后,加入刺激剂(PMA和Ionomycin),孵育5小时。
10)收集上清,进行ELISA检测。
抑制效率%=1-共培养组TNFα/PBMC对照组TNFα%
注:同一个共培养细胞上清液设置3个复孔检测
1)收集细胞,进行流式检测TNF-α
a)收集样本孔中细胞,台盼蓝染色计数;
b)细胞离心后,去上清,残留液大约100μL,每管加1mL FoxP3固定/破膜工作液,室温避光孵育30min; FoxP3/转录因子染色缓冲液试剂盒(货号:00-5523);
c)每管加入2mL 1X破膜液,500g离心5min,弃上清;
d)在残留的1X破膜液中重悬细胞,倒出上清液后大约残留100μL;
e)向细胞悬液中加入TNF α-PE,避光孵育30min;
f)每管加入2mL 1X破膜液,500g离心5min,弃上清;
g)加入适量的流式细胞染色缓冲液重悬染色的细胞,流式细胞仪分析样本。
抑制效率%=1-共培养组TNFα% / PBMC对照组TNFα%