文章目录
流式样本制备
所有流式细胞术检测的样本均需是单细胞悬液。外周血中的或悬浮生长的细胞十分方便制备成单细胞悬液,而贴壁细胞、实体组织或肿瘤组织需先制备成单细胞悬液,才能完成流式分析实验方案。目前制备单细胞悬液的方法有很多,其中常用到酶消化或机械性组织解离。当使用螯合剂或酶消化处理样本时,应格外注意,因为此类解离过程可能会破坏细胞上的抗原表达。还有,在任何情况下都应该去除流式样本中的细胞团块、死细胞和碎片,使得最终排除假阳性以及获得最佳的结果。
1. 从人全血中分离PBMC
(1)采用普通离心管分离外周血单个有核细胞(PBMC)
材料
• HapClult™ 磷酸盐缓冲液(# 201054)
• 15 mL或50 mL离心管(# 339650)
• ImunoSep™密度梯度细胞分离液(# LSB1077)
实验步骤
注:使用本实验方案进行细胞分离需使用实验方案中提到的各项产品,不建议更换不同产品。
注:若继续培养分离的细胞,所有步骤均需无菌操作,并使用不含叠氮化物的缓冲液。
1. 在离心管中,使用PBS以至少1:1的比例稀释血液样本。
2. 准备与稀释前全血样本相同体积的Ficoll,加入到离心管的底部(或在Ficoll的上层缓缓加入稀释后的全血)。
3. 在室温下,以400 x g离心20分钟(离心过程中务必使“Brake”按键处于关闭状态,或将离心机加减速调至最低)。
4. 采集PBS和Ficoll层交界处的PBMC到新试管内。
5. 在离心管中加入适量PBS,洗涤细胞。
6. 在2-8°C下,以 300-400 x g离心细胞4-5分钟。弃掉上清液。
7. 用适量的流式细胞染色缓冲液(Flow Cytometry Staining Buffer,# 222026)重悬细胞,然后进行细胞计数和活性检测。
8. 重复步骤6离心细胞,然后用流式细胞染色缓冲液重悬细胞,使细胞最终浓度达到1 x 107个细胞/mL(细胞终浓度可随不同实验要求而不同)。
(2)采用密度梯度离心管分离外周血单个有核细胞(PBMC)
材料
• 流式细胞染色缓冲液(# 222026)
• HapClult™ 磷酸盐缓冲液(# 201054)
• 15 mL或50 mL离心管(# 339650)
• SepTube™密度梯度离心管(# 601150/601115)
• ImunoSep™密度梯度细胞分离液(# LSB1077)
实验步骤
注:使用本实验方案进行细胞分离需使用实验方案中提到的各项产品,不建议更换不同产品。
注:若继续培养分离的细胞,所有步骤均需无菌操作,并使用不含叠氮化物的缓冲液。
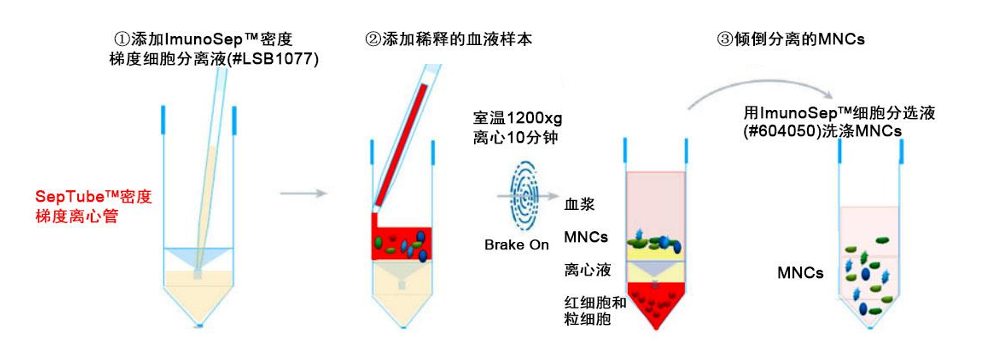
为取得较好的 MNCs 分离效果,请确保 ImunoSep™细胞分选液(#604050 )、ImunoSep™密度梯度细胞分离液(#LSB1077)和离心机在室温(15-25℃)状态下。
1) 用等体积的 ImunoSep™细胞分选液(#604050)稀释抗凝血,混合均匀。如:5 mL 抗凝血用 5 mL ImunoSep™细胞分选液(#604050)稀释。
2) 将 ImunoSep™密度梯度细胞分离液(#LSB1077)通过隔板中心的孔注入 SepTube™密度梯度离心管 (如上图 ①)。
注入分离液的体积请参考下表。

3) 保持 SepTube™密度梯度离心管垂直,通过血清移液管将稀释的样品沿管壁加入管中(如上图 ②)。 样品将会和隔板上方的分离液混合,但不会影响分离效果。
注:样品也可以直接倒入SepTube™管中,但要小心避免样品通过隔板中央的小孔直接进入隔板下方的分离液中。
4) 水平转子离心机,在开启离心机制动器的情况下,室温1200×g离心10分钟。
注:如果样品在体外超过 24 h 以上,建议离心20 分钟以上。
离心力(g)和转速(rpm)转换公式: 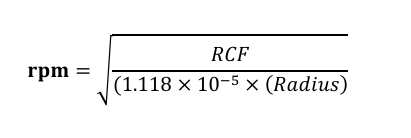
注:rpm:每分钟转速;RCF:相对离心力;Radius:离心机转子半径(cm)
5) 离心完成后,将隔板上方包含MNCs和血浆的混合液直接倒入新的离心管中。
注:请勿倒置SepTube™密度梯度离心管超过2秒,以免倒出底层红细胞与粒细胞。
注:离心后,SepTube™密度梯度离心管隔板上表面可能存在少量红细胞,但这些少量的红细胞不会影响下游实验。如果SepTube™密度梯度离心管隔板上表面发现有较多的红细胞,可能是由于采血时间较长引起的,此时可以继续 1200×g离心10分钟,以减少红细胞的残留。
6) 在 MNCs 离心管中添加 0.5-1 倍体积ImunoSep™细胞分选液(#604050),室温300×g 离心8分钟洗涤细胞。
7) 弃上清。
8) 重复步骤6)和7)。
9) 重悬细胞备用。
注意:
1) SepTube™-15 用于处理0.5-5 mL起始血量,SepTube™- 50用于处理4-17 mL起始血量。
2) SepTube™密度梯度离心管用于从外周血、脐带血或骨髓中分离单个核细胞。血液样品储存时间不超过48 h、采血2 h内的样品,分离效果较好。
3) 如果偶然出现 SepTube™隔板插件离心后上浮,请勿倾倒管中的液体收集单个核细胞,此种情况请用无菌镊子移除隔板插件后,再用吸管收集单个核细胞,整个过程操作须小心细致。
4) 由于不同疾病状态下的血液与健康人群的血液存在差别,SepTube™分离单个核细胞的效果存在差异属于正常情况,可以根据实际分离情况调整离心时间和血液的稀释倍数,以便取得较好的分离效果。
2. 从小鼠骨髓中分离细胞
本实验方案适用于分离骨髓中的细胞。与全血相比,骨髓中包含的细胞类型更为复杂,包括造血干细胞(可分化成白细胞、红细胞和血小板等)以及基质细胞(如内皮细胞、成纤维细胞、巨噬细胞、成骨细胞、破骨细胞和脂肪细胞)。
材料
• 细胞培养皿(# 150466)
• 实验室擦拭纸(# 06-666)
• 乙醇(# T038181000CS)
• RPMI完全培养基
– 可 选:青霉素-链霉素(# 213010)
• 手术刀和刀片
• 5-10 mL注射器
• 25号针头
• 70 μm细胞筛
• 50 mL离心管(# 339652)
• 1X 红细胞裂解液(# 212010)或 10X 红细胞裂解液 [多物种] (# 00-4300-54)
• Invitrogen Countess 3自动细胞计数仪(# AMQAX2000)
• 磷酸盐缓冲盐水(PBS)(# 201054)
实验步骤
细胞分离
1. 在无菌条件下,分离小鼠的股骨骨髓,并放入无菌细胞培养皿中。
注:在冲洗股骨获得骨髓后,还可使用研钵和研杵压碎股骨来获得更多细胞。骨髓也可以从压碎的骨盆骨和胫骨中分离获得。
2. 使用镊子和小剪刀剪掉肌肉组织和纤维组织。如果仍有肌肉组织附着于股骨上,则用蘸有70%乙醇的Kimwipe擦拭纸擦拭股骨,去除多余的肌肉纤维。
3. 往新的无菌细胞培养皿中加入5–7 mL RPMI完全培养基。RPMI 1640完全培养基制备方法:添加胎牛血清(最终浓度达10%)和2 mM 左旋谷氨酰胺(如果使用的是不含GlutaMAX的培养基)到RPMI 1640培养基中。RPMI 1640完全培养基制备方法:向RPMI 1640培养基中添加胎牛血清,使终浓度到10%;且若不含GlutaMAX,则添加 2 mM左旋谷氨酰胺。
可选:向培养基中添加1%青霉素-链霉素培养基(5,000 单位/mL)。
4. 用手术刀或锋利的剪刀切下股骨两端,确保两端干净。
5. 将25号针头装在10 mL注射器上,用注射器抽吸5 mL RPMI完全培养基。
6. 用镊子将骨头直立于细胞培养皿上方,用注射器小心地将骨髓冲洗到细胞培养皿中。在必要时,重复冲洗;当骨头呈白色则表明已冲出所有骨髓。对所有骨头重复该步骤。
7. 将一个70 μm细胞筛放置在一个新的50 mL离心管顶部(离心管应竖直放置在管架上)。
8. 使用无菌血清移液器,将所有骨髓从细胞培养皿中转移到细胞筛中。并用适量的RPMI完全培养基冲洗细胞培养皿,继续将残留于培养皿中的骨髓转移到细胞筛中。
9. 使用10 mL注射器的柱塞(请勿触摸柱塞的黑色橡胶,保持无菌),向下顺/逆时针碾碎70 μm细胞筛中的骨髓。确认骨髓均被捣碎,没有块状。
10. 用适量的RPMI完全培养基将柱塞端剩下的骨髓冲到筛网中,尽可能多收集细胞。
11. 用5–7 mL RPMI完全培养基彻底冲洗筛网。之后取下筛网,并将含有样本的离心管盖上盖子。
12. 在4°C下,以 600 x g离心细胞4分钟。弃掉上清液。
13. 向离心管中加入约5 mL RPMI完全培养基,上下吹打以重悬细胞。
14. 将一个新的70 μm细胞筛放置在管架上一个新50 mL离心管的顶部。
15. 将重悬的骨髓样本重新过一次细胞筛并保存在离心管中。如需,检测细胞活性。
16. 用适量的RPMI完全培养基重悬细胞样本,最终达到所需的细胞浓度。
细胞计数
1. 使用红细胞裂解液裂解骨髓细胞样本中的红细胞,方便进行免疫细胞计数。向100 μL样本中加入1 mL 1X 红细胞裂解液(# 212010)。
2. 在室温下孵育4–5分钟,期间偶尔轻摇或旋转。
3. 加入2–3 mL 1X PBS,终止裂解反应。
4. 在4°C下,以600 x g离心细胞4分钟。弃掉上清液。
5. 向离心管中加入约500 μL RPMI完全培养基,上下吹打以重悬细胞。
6. 使用Invitrogen Countess 3自动细胞计数仪或血球计数板对活细胞进行计数。
可选:使用Invitrogen MagniSort试剂盒对所需免疫细胞亚型进行磁珠分选,或使用CD3功能性抗体、CD28功能性抗体或细胞刺激试剂盒(Cell Stimulation cocktail,货 号00-4975-93)对细胞进行刺激处理。
3. 小鼠脾细胞分离实验方案
脾脏是一个具有造血功能、红细胞清除和免疫功能的器官,因此脾脏十分适合获取免疫细胞。它能够清除掉病原体、异常细胞和细胞碎片,主要有红细胞和淋巴细胞,是多种免疫细胞亚型(包括粒细胞、单核细胞、巨噬细胞、树突状细胞[DC]、NK细胞、T细胞和B细胞)的来源。淋巴细胞可直接通过脾细胞初步分离得到,而DC和巨噬细胞则需先对脾脏进行酶消化,再进行脾细胞初步分离得到。
材料
•10X 红细胞裂解液 [多物种](# 00-4300-54)
• PBS,pH 7.4(# 201054)
• 50 mL离心管(# 339652)
• 细胞培养皿(# 150466)
• 手术刀和刀片
• 一次性移液器
• 70 μm细胞筛
• 5-10 mL注射器
• Hanks'平衡盐溶液
髓系细胞制备
• 胶原酶(# 17104019)
• DNase(# 606001)
• 胎牛血清(# FBS141-500)
• EDTA(# 15575020)
实验步骤
1. 获取整个新鲜小鼠脾脏。
2. 将小鼠脾脏放入含5 mL HBSS缓冲液(Hanks' 平衡盐溶液)的培养皿中。
3. 使用刀片或手术刀,小心将脾脏切成小块(~0.2 cm2)。若只进行简单的细胞分离,直接进行步骤5。
4. 髓系细胞制备如下:在37°C下,使用 5 mL含IV型胶原酶(100 U/mL)和1% FBS的DNase(20 µg/mL)的HBSS溶液消化小块状的脾脏,孵育20–30分钟。然后加入1 mM/mL EDTA,在室温下消化 5分钟后,终止酶消化反应。
5. 将细胞筛放在50 mL离心管上方。
6. 使用一次性移液器,将消化后的脾组织转移到细胞筛上。
7. 使用注射器柱塞端,捣碎或碾碎脾脏,使其通过筛网。若有需,加入5–10 mL PBS冲洗。
8. 用适量的PBS冲洗细胞,使其通过筛网。如有必要,重复步骤5、6。
9. 在4°C下,以400-600 x g离心细胞5分钟。弃掉上清液。
10. 用2–5 mL预冷的1X 红细胞裂解液(# 212010)重悬细胞。
11. 将细胞悬液置于冰上孵育5分钟。
12. 用10-20 mL冷的PBS洗涤细胞悬液。
13. 在4°C下,以400-600 x g离心细胞5分 钟。弃掉上清液。
14. 用适量PBS重悬细胞,使细胞终浓度达到2-3×106个细胞/mL。
4. 流式细胞染色方案:全血样本
这里的实验方案是通过流式检测全血样本中的细胞免疫表型,操作简单,这使得保留细胞结构功能和减少细胞损失。全血中RBC与单个有核细胞比例约为600:1(取决于样本和物种);若目的是观察到稀少细胞群,需要更多全血样本量。在流式表面染色实验中,使用抗体标记全血样本中的细胞后可以上机分析;其中红细胞(RBC)可以在抗体染色后再裂解。在流式胞内染色实验中,全血样本裂解红细胞后,细胞破膜、抗体染色胞内标记物,随后即可流式分析。
材料
• 含有抗凝血剂(肝素、K3EDTA或K2EDTA)的采血管
• 12 × 75 mm 聚苯乙烯圆底试管(# 12-007S)
• 流式细胞染色缓冲液(# 222026)
• 荧光标记一抗(例如经多重验证的Invitrogen流式抗体)
• 磷酸盐缓冲液(PBS)(# 201054)
• 1× 红细胞裂解液(# 212010)或 10X 红细胞裂解液 [多物种](# 00-4300-54)
• Invitrogen eBioscience破膜缓冲液[10X] (# 00-8333-56)
• 可选:70 μm细胞筛
• 可选:Invitrogen SYTOX细胞活性染色试剂盒[用于流式细胞分析](# S34862)
• 可选:Invitrogen eBioscience 一步法固定/裂解液[10X](# 00-5333-54)实验步骤
全血样本处理
1. 使用肝素采样管采集全血,或使用含有10% EDTA二钾(1 μL/100 μL全血)的采样管。
2. 取100 μL未裂解的全血样本加到12×75 mm试管中,分别作为抗体染色管和单色对照管(用于补偿调节);剩余未裂解的全血样本可制备未染色空白对照管。
细胞表面染色
1. 准备抗体混合管:将流式抗体(靶标为细胞表面标记物的荧光标记抗体)加入到流式细胞染色缓冲液(Flow Cytometry Staining Buffer,# 222026)中。建议初次测试1:50 至1:100的抗体稀释比例。避光。
注:相比于裂解后全血或血清,未裂解全血样本应用的抗体浓度应该更高。
2. 将抗体混合物加到100 μL全血中。
3. 在2-8°C下振荡孵育30分钟至1小时。避光。
4. 用2 mL流式细胞染色缓冲液(Flow Cytometry Staining Buffer)洗涤样本 。可重复洗涤。
5. 在4°C下以500 x g离心5分钟。弃掉上清液,然后用 500 μL流式细胞染色缓冲液(Flow Cytometry Staining Buffer)重悬细胞。.
可选 :(若使用固定液或裂解液,请勿进行此步骤)在此步,加入SYTOX细胞活性染料(# S34862),用于对活细胞设门。加入这类染料后,孵育后可直接上机检测,不需再洗涤样本。例如:向每500 μL样本中加入0.5 μL的SYTOX细胞活性染料(SYTOX™ Dead Cell Stain for ow cytometry),混匀。在室温下避光孵育20分钟。
6. 可选:如果直接上机分析样本,在室温下用70 μM细胞筛过滤细胞,去除较大碎片。
可选: 红细胞裂解
1. 在室温下,向100 μL全血中加入2 mL的1X一步法固定/裂解液(# 00-5333-54),然后轻轻上下颠倒混匀。裂解红细胞将使设门分析更加准确,即使可能会影响免疫细胞功能。在这里,一步法固定/裂解液(1-step Fix/Lyse Solution)同时实现裂解红细胞和固定细胞,更重要的是稳定淋巴细胞群上的荧光抗体标记。
2. 在室温下避光孵育15-60分钟。
3. 样本可避光储存于2-8°C中,时间不超过48小时。应在相同条件下储存用于补偿调节的单色对照样本和未染色空白对照样本。
流式细胞术分析
1. 上机分析样本。流式细胞仪配置的滤光片通道与所选的荧光染料吻合。
2. 为达到1–10%的CV值,必须采集至少105–107个细胞数才有检测深度为0.1%的细胞群。采集速率应设置为慢速收集(若使用Invitrogen Attune流式细胞仪,则收集速率为200–500 μL/min)。
注:白细胞应为4,000-10,000个细胞/mL。建议计算出若需具有统计学意义的结果所需的细胞数,以估算实验所需的血液量。
流式胞内染色
1. 在流式胞内抗体(靶标为细胞内标记物的流式抗体)标记前,使用2 mL/ 100 μL全血的1X一步法固定/裂解液(# 00-5333-54)裂解红细胞并固定淋巴细胞。轻轻上下颠倒混匀,在室温下避光孵育15-60分钟。
2. 将10X破膜缓冲液(# 00-8333-56)稀释至1X:将1份10X浓缩液与9份蒸馏水混合。
3. 在室温下,以500 x g离心样本5分钟。弃掉上清液。
4. 用2 mL 1X破膜缓冲液(# 00-8333-56)重悬细胞沉淀物,在室温下以500 x g离心5分钟。弃掉上清液。重复一次。避光。
5. 用100 µL流式细胞染色缓冲液(# 222026)重悬细胞沉淀物。
6. 准备抗体混合管:将流式胞内抗体(靶标为细胞内标记物的流式抗体)加到流式细胞染色缓冲液(Flow Cytometry Staining Buffer)中。避光。建议初次测试1:50至1:100的抗体稀释比例。
7. 向细胞悬液中加入抗体混合物。
8. 在室温下上下颠倒混匀,孵育20-60分钟。避光。
9. 用2 mL流式细胞染色缓冲液(Flow Cytometry Staining Buffer)洗涤样本 。可重复洗涤。
10. 在4°C下,以 500 x g离心5分钟后,弃掉上清液。然后用 500 µL流式细胞染色缓冲液(Flow Cytometry Staining Buffer)重悬细胞。
11. 上样到流式细胞仪中,分析样本。
5. 红细胞裂解
在流式分析淋巴组织细胞悬液或外周血之前,通常红细胞(RBC)应当除去。尤其在流式分析人外周血中,应将红细胞裂解写在实验方案中。1X红细胞裂解液(# 212010)和10X 红细胞裂解液【多物种】(# 00-4300)适合用于裂解人外周血和小鼠组织(例如脾)细胞悬液中的红细胞,其中含有用于裂解红细胞的氯化铵,对白细胞的影响极小。10X一步法固定/裂解液(# 00-5333)允许在荧光抗体染色后同时进行红细胞裂解和淋巴细胞固定。Invitrogen eBioscience 红细胞裂解液与所有荧光标记抗体相兼容。
红细胞裂解方案
• 方案A:使用1X或10X红细胞裂解缓冲液
– A1. 在全血样本中抗体染色后裂解红细胞
– A2. 在大体积人全血样本中裂解红细胞
– A3. 在小鼠/大鼠脾脏或骨髓样本中裂解红细胞
• 方案B:使用一步法固定/裂解液
方案A:使用1X或10X 红细胞裂解缓冲液
红细胞裂解液的原理是由氯化铵产生的渗透压破碎无核红细胞,适用于全血样本(肝素或EDTA作为抗凝剂)或组织细胞悬液样本。10X 红细胞裂解液(多物种)(# 00-4300)适用于外周血中红细胞的裂解,在人、小鼠、大鼠、犬和非人灵长类动物来源全血上得到验证;1X 红细胞裂解液(# 212010)适用于裂解人外周血或小鼠造血组织(如脾脏或骨髓)细胞悬液中的红细胞。
材料
• 1X PBS
• 10X 红细胞裂解液(多物种)(# 00-4300)或1X 红细胞裂解液(# 212010)
• 50 mL离心管
• 流式细胞染色缓冲液(# 222026)
• 12 × 75 mm圆底试管
• 荧光标记一抗
实验步骤
A1. 在全血样本中抗体染色后裂解红细胞
1. 向试管中加入全血样本。
注:· 对于人,使用100 µL的血样。• 对于小鼠,使用50-100 µL的血样。• 对于大鼠,使用50-100 µL的血样。• 对于犬,使用100 µL的血样。• 对于非人灵长类动物,使用100 µL的血样。
2. 加入抗体(总体积不得超过50 µL),充分混匀。
3. 在室温下避光孵育30分钟。
注:• 对于人,孵育10–15分钟。• 对于小鼠,孵育4-10分钟。• 对于大鼠,孵育4-10分钟。• 对于犬,孵育10–15 分钟。• 对于非人灵长类动物,孵育10–15分钟。
4. 加入2 mL 常温的1X 红细胞裂解液(# 212010),然后涡旋或颠倒混匀。
5. 在室温下避光孵育。
6. 裂解后,立即在室温下以500 x g离心5分钟。弃掉上清液。
7. 可选:重复步骤4-6。
8. 用2 mL流式细胞染色缓冲液(# 222026)重悬细胞,然后按照步骤6离心。
9. 弃掉上清液,用适量的流式细胞染色缓冲液重悬细胞。
10. 上样到流式细胞仪中,分析样本。
A2. 在大体积人全血样本中裂解红细胞
1. 向每1 mL的人全血中加入10 mL的1X 红细胞裂解液(# 212010)。
2. 在室温下孵育10-15分钟(不得超过15分钟)。
3. 在室温下,以500 x g离心5分钟。弃掉上清液。
4. 用适量的流式细胞染色缓冲液(# 222026)重悬细胞。
5. 细胞计数和活性检测。
6. 如有需要,继续进行细胞染色或培养。
A3. 在小鼠/大鼠脾脏或骨髓样本中裂解红细胞
1. 收集组织样本并制备成单细胞悬液。
2. 在室温下,以500 x g离心5分钟。弃掉上清液。
3. 用3-10 mL 1X 红细胞裂解液(# 212010)重悬细胞。
4. 在室温下孵育4-5分钟。
5. 加入20–30 mL的1X PBS终止裂解反应。
6. 立即在室温下以500 x g离心5分钟。弃掉上清液。
7. 用2 mL流式细胞染色缓冲液(# 222026)重悬细胞,按照步骤6离心。弃掉上清液。
8. 用适量的流式细胞染色缓冲液重悬细胞。
9. 细胞计数和活性检测。
10. 如有需要,继续进行细胞染色或培养。
方案B:使用一步法固定/裂解液1-step Fix/Lyse Solution
一步法固定/裂解液(# 00-5333)可裂解红细胞并同时固定淋巴细胞。它适用于抗体染色后裂红和固定,最终上样分析;也适用于裂红和固定后再使用抗体染色,但请注意确认所用抗体仍然能识别细胞固定后的抗原表位。还有,机械性组织解离法通常可以将淋巴组织处理为单细胞悬液。
材料
• 流式细胞染色缓冲液(# 222026)
• 10X 一步法固定/裂解液(# 00-5333)
• 1X PBS
• 50 mL离心管
• 12 × 75 mm圆底试管
• 荧光标记一抗
实验步骤
1. 向100 μL的全血中加入细胞表面染色的抗体,充分混合。
2. 请参考最佳染色方案thermosher.cn/cellsurfacetargets中的流式细胞表面染色方案。
3. 在室温下,避光孵育30分钟。
4. 加入2 mL的常温1X 一步法固定/裂解液(# 00-5333),然后轻轻颠倒。
5. 在室温下,避光孵育15-60分钟。
6. 可选:若在1X 一步法固定/裂解液中保存样本,在2–8ºC下最多3天(避光:对荧光亮度的影响降到最低)。