文章目录
细胞增殖
本文详细介绍了使用不同方法进行细胞增殖检测的完整protocol
1. 细胞增殖检测
介绍
检测细胞增殖能力是评估细胞健康状况和基因毒性以及评价抗癌药物的基本方法。最准确的方法是直接检测DNA的合成。最初,通过掺入的放射性核苷(即3H-脱氧胸腺嘧啶核苷)可以检测DNA合成,随后基于抗体的溴脱氧尿苷(BrdU,核苷类似物)检测法取代了它。Click-iT™ Plus EdU细胞增殖试剂盒是替代BrdU检测的新方法。EdU(5-乙炔基-2'-脱氧尿苷)是脱氧胸腺嘧啶核苷类似物,在DNA合成活跃期掺入DNA中。该检测的原理是点击反应,这是铜催化的吡啶甲基叠氮化物和炔烃之间的共价反应。在这个反应中,EdU的乙炔基团提供炔烃,而吡啶甲基叠氮化物与Alexa Fluor™ 350染料、Alexa Fluor™ 488染料、Alexa Fluor™ 594染料、Alexa Fluor™ 647染料或Pacific Blue™染料结合。图1展示了标准流式细胞方法用于确定细胞群中S期细胞的百分比。
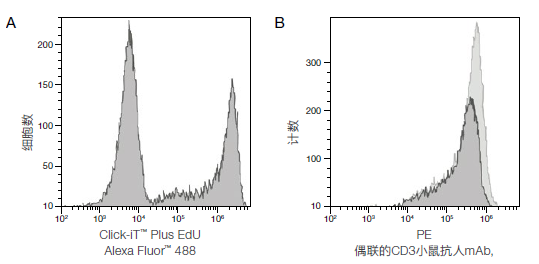
图1. Alexa Fluor™ 488 Click-iT™ Plus EdU细胞增殖试剂盒和抗人CD3小鼠mAb-PE检测Jurkat( 人T细胞白血病细胞系)细胞的荧光信号。用10μM EdU处理Jurkat细胞2小时,再用CD3小鼠抗人mAb,PE(#MHCD0304)染色并上机分析。上图的检测结果中,明显区分了掺入EdU的增殖细胞和未掺入EdU的非增殖细胞。图A显示了在Attune™声波聚焦流式细胞仪上使用488 nm激光器和530/30 nm带通滤光片,分析Alexa Fluor™ 488吡啶甲基叠氮化物标记的细胞频率;图B显示了使用561 nm激光器的细胞数据。直方图中黑色显示的是用CD3小鼠抗人mAb,PE和Click-iT™ Plus EdU Alexa Fluor™ 488吡啶甲基叠氮化物染色的细胞。直方图中灰色显示的是CD3小鼠抗人mAb, PE阳性对照细胞,该细胞经过相同处理但反应中不含铜。
Click-iT™ Plus EdU标记的优势在于小分子的吡啶甲基叠氮染料在温和条件下可高效检测掺入的EdU。一般的醛基固定和去污剂破膜足以让Click-iT™ Plus进入DNA。与之相反,BrdU检测需要使用酸、加热或用DNase消化使DNA变性,BrdU才能暴露以便用抗BrdU抗体检测。当使用酸变性方法时,BrdU法处理样本会改变细胞周期信号的分以及导致抗原识别位点的破坏。相比之下,Click-iT™ Plus EdU细胞增殖试剂盒与细胞周期染料、R-PE、R-PE的串联染料和荧光蛋白(例如GFP、RFP和mCherry)兼容,可以与针对表面和细胞内标记物的抗体进行多参数分析(图2)。
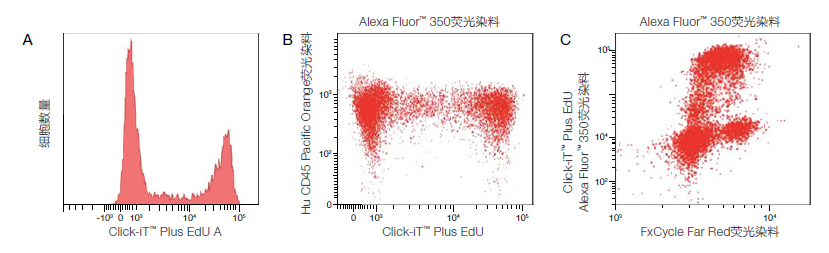
图2. Alexa Fluor™ 350 Click-iT™ Plus EdU细胞增殖试剂盒、CD45-Pacific Orange™和FxCycle™ Far Red 检测Jurkat(人T细胞白血病细胞系)细胞。用10μM EdU处理Jurkat细胞2小时,用CD45-Pacific Orange™(#MHCD4530)染色进行检测。图片展示的是掺入EdU的增殖细胞和未掺入EdU的非增殖细胞。图A显示了使用UV激发和450/50 nm带通滤光片, Alexa Fluor™ 350吡啶甲基叠氮染料标记细胞的数据;图B显示了使用405 nm激光激发和530/30 nm带通滤光片检测CD45-Pacific Orange™ 和使用UV激发和450/50 nm带通滤光片检测Alexa Fluor™ 350吡啶甲基叠氮染料的相同细胞;图C显示了使用UV激发和450/50 nm带通检测Click-iT™ Plus EdU Alexa Fluor™ 350和FxCycle™ Far Red的双参数图。
材料
试剂盒中提供的组分
| 内容物 | #C10632 | #C10634 | #C10636 | #C10645 | #C10646 |
储存条件 |
| EdU(组分A) | — | — | 10 mg | — | — | • 2-8°C • 干燥剂 • 避光 • 请勿冷冻 |
| Alexa Fluor™ 350吡啶甲基叠氮化物(Alexa Fluor™ 350picolyl azide);在DMSO中(组分B) | — | — | — | 130 µL | — | |
| Alexa Fluor™ 488吡啶甲基叠氮化物(Alexa Fluor™ 488 picolyl azide);在DMSO中(组分B) | 130 µL | — | — | — | — | |
| Alexa Fluor™ 594吡啶甲基叠氮化物(Alexa Fluor™ 594 picolyl azide);在DMSO中(组分B) | — | — | — | — | 130 µL | |
| Alexa Fluor™ 647吡啶甲基叠氮化物(Alexa Fluor™ 647 picolyl azide);在DMSO中(组分B) | — | 130 µL | — | — | — | |
| Pacific Blue™吡啶甲基叠氮化物(Pacific Blue™ picolyl azide);在DMSO中(组分B) | — | — | 130 µL | — | — | |
| 二甲基亚砜(DMSO)(组分B) | 4.5ml | |||||
| Click-iT™固定剂(Click-iT™ fixative)(含4%多聚甲醛的PBS)(组分D) | 5ml | |||||
| Click-iT™可固定皂苷类破膜洗涤试剂10X(Click-iT™ fixative saponin-based permeabilization and wash reagent, 10X),(组分E) | 50ml | |||||
| 铜保护剂(Copper protectant),100 mM水溶液组分F) | 0.5ml | |||||
| Click-iT™ EdU缓冲添加剂(Click-iT™ EdU buffer additive)(组分G) | 400mg |
需要但未提供的材料
• 含1%牛血清白蛋白(BSA)的磷酸盐缓冲液(PBS),pH 7.1–7.4
• 缓冲液,例如PBS、D-PBS或TBS
• 去离子水或18 MΩ纯净水
• 12 × 75 mm管,或其他流式管
操作步骤
试剂制备
- 试剂盒平衡至室温。
- 将4 mL的DMSO(组分C)或水溶液(PBS)加入组分A中并充分混匀,制成10 mM的EdU溶液。使用后,剩余溶液储存在≤–20°C条件下可稳定储存长达1年。
- 将130 μL的DMSO加入组分B中并充分混合,制备Pacific Blue™吡啶甲基叠氮化物( #C10418)、Alexa Fluor™ 647吡啶甲基叠氮化物(#C10424)或Alexa Fluor™ 488吡啶甲基叠氮化物(#C10425)的工作液。使用后,将剩余溶液储存在≤–20°C条件下,可稳定储存长达1年。
- 将50 mL组分E加入450 mL 1% BSA的PBS溶液中,以制备500 mL 1X Click-iT™皂苷类破膜洗涤试剂可使用含1% BSA的PBS以1:10的比例稀释一定体积的组分E来制备更少量的组分。使用后,将剩余的溶液储存在2–6°C条件下。按指示储存时,1X溶液可稳定储存6个月,10X溶液可稳定储存12个月。注:组分E含有叠氮化钠(参见安全警告)。
- 向小瓶中加入2 mL去离子水并混匀,直到Click-iT™ EdU buffer additive(组分G)完全溶解,以制备10X Click-iT™ EdU buffer additive储存液。使用后,将剩余溶液储存在≤–20°C条件下,可稳定储存长达1年。
安全警告
• 在该试剂盒中,DMSO(组分B和C)以溶液形式供应,众所周知,DMSO有助于有机分子进入组织。处理含有DMSO的试剂时,应选择适用于此类材料的设备和操作,避免安全事故。按照所有相关的地方法规处置试剂。
• Click-iT™ 固定剂Click-iT™ fixative(组分D)含有危化品多聚甲醛。使用时应采取适当的预防措施。
• Click-iT™ 皂苷类破膜洗涤试剂reagent (组分E)含有叠氮化钠,在酸性条件下会产生剧毒的叠氮酸。丢弃前,应在自来水中稀释叠氮化合物,以避免管道中蓄积潜在的爆炸性沉积物。
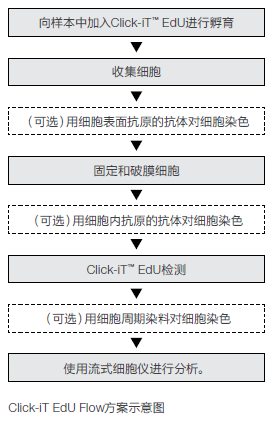
用EdU标记细胞
以下方案是使用Jurkat细胞(人T细胞系)和浓度为10 μM的EdU开发,但该方案适用于任何细胞类型。培养基、细胞密度、细胞类型等这些因素可能会对标记造成影响。在预实验阶段,建议对特定细胞类型进行测试,梯度测试不同的EdU浓度以获得最佳的染色浓度和实验条件。如果目前使用BrdU法检测细胞增殖,则建议EdU的最适浓度首先从与使用BrdU接近的浓度开始尝试比较好。如果样本是全血,建议收集管采用肝素抗凝管。
6.将细胞混混悬在适当的培养基中,优化培养条件。在EdU孵育之前,温度改变或洗涤都会干扰细胞减缓细胞的增殖和染料掺入。
7.将EdU工作液加入到培养基中并混匀达到适宜的终浓度。建议使用10μM的起始浓度孵育 1-2小时。如果孵育时间更长,建议降低浓度。如果孵育时间更短,可能需要更高的浓度。未经EdU处理的相同细胞群作为未染色的阴性对照。
8. 根据细胞类型优化孵育时间和条件。改变细胞孵育EdU的时间或用EdU对细胞进行脉冲标记,获取DNA合成和增殖的各项参数。脉冲标记的有效时间间隔和时长取决于细胞生长速率。
9.如果需要进行抗体表面标记,则收集细胞并立即进行步骤10;否则继续进行步骤16。
细胞表面抗原染色(可选)
10. 用3 mL 含1% BSA的PBS洗涤细胞一次,离心得到细胞团,弃掉上清液。
11. 用含1% BSA的PBS重悬细胞至1×107个细胞/mL。
12. 将100μL的细胞悬液或全血样本加入流式管中。
13. 加入抗体并混匀(表1)。
14. 按照建议的时间和温度避光孵育。
15. 继续步骤16进行细胞固定。
注:在进行点击反应之前请勿使用PE、PE-串联染料或Qdot™抗体偶联物;直到步骤21-23使用这些荧光基团进行标记。
表1.Click-iT™ Plus EdU检测试剂与荧光染料的兼容性。
| 荧光染料 | 兼容性 |
| R-藻红蛋白(R-PE)和基于R-PE的串联染料(即Alexa Fluor™ 610-RPE) | 兼容,Alexa Fluor™ 594与R-PE-Cy7™串联染料除外 |
| 荧光蛋白(GFP) | 兼容 |
| PerCP、别藻蓝蛋白(R-APC)和基于APC的串联染料(即Alexa Fluor™ 680-APC) | 兼容 |
| 有机染料,例如Alexa Fluor™染料、荧光素(FITC) | 兼容 |
| Qdot™纳米晶体 | 在Click-iT™ Plus检测反应后使用Qdot™纳米晶体 |
*兼容性是指用于Click-iT™ Plus EdU检测的铜催化时,荧光染料本身或检测方法是否存在不稳定的组分。
固定和破膜
Click-iT™皂苷类破膜洗涤试剂(Click-iT™ saponin-based permeabilization and wash reagent)可用于全血或含有红细胞的细胞悬液,以及含有多种细胞的悬液。这种破膜洗涤试剂在裂解红细胞的同时保持了白细胞的形态学光散射特性。
16. 用3 mL 含1% BSA的PBS洗涤细胞一次,离心得到细胞团,弃掉上清液。
17. 加入100 μL Click-iT™ 固定剂(Click-iT™ fixative)(组分D),并充分混匀。
18. 将细胞在室温下避光孵育15分钟。
19. 用3 mL含 1% BSA的PBS洗涤细胞,离心得到细胞团,弃掉上清液。如果样本还可见红细胞或血红蛋白残留,则重复洗涤步骤。确保去除所有残留的红细胞碎片和血红蛋白。
20. 用100 μL的1X Click-iT™皂苷类破膜洗涤试剂(Click-iT™ saponin-based permeabilization and wash reagent)(在步骤4中制备)重悬细胞,并充分混匀。将细胞孵育15分钟或直接进行步骤24。
表面或胞内抗原染色(可选)
21. 向细胞悬液中加入标记细胞表面抗原或胞内抗原的Qdot™偶联抗体,充分混匀。
22. 按照抗体染色所需的时间和温度避光孵育。
23. 根据是否已操作Click-iT™ EdU检测步骤从下列表格中选则相应的洗涤细胞步骤:
| Click-iT™ EdU检测 | 操作 |
| 已操作Click-iT™ EdU检测步骤 | 1. 用3 mL的1X Click-iT™透膜洗涤试剂(1X Click-iT™ permeabilization and wash reagent)清洗样本。 2. 离心并去上清。 3. 用500 μL 1X Click-iT™破膜洗涤试剂(1X Click-iT™ permeabilization and wash reagent)重悬细胞。 4. 继续进行“细胞染色用于DNA含量测定”(步骤29)或“使用流式细胞仪进行分析”(步骤31) |
| 尚未操作Detect Click-iT™ EdU步骤 | 1. 用3 mL 含1% BSA的PBS洗涤细胞一次,离心得到细胞团,弃掉上清液。 2. 加入100 μL 1X Click-iT™破膜洗涤试剂(1X Click-iT™ permeabilization and wash reagent),并充分混匀。 3. 继续进行“Click-iT™ EdU检测”(步骤24) |
Click-iT™反应
24. 用去离子水以1:10的比例稀释10X储备液(在步骤5中制备),制备1X Click-iT™ EdU缓冲液(Click-iT™ EdU buffer)。
25. 根据表2制备Click-iT™反应混合物(Click-iT™ reaction cocktail)。
注:在制备后15分钟内使用Click-iT™反应混合物。
表2.Click-iT™ Plus EdU反应混合物
| 反应次数 | |||||||
| 反应组分 | 1 | 2 | 5 | 10 | 15 | 30 | 50 |
| PBS、D-PBS或TBS | 438 µL | 875 µL | 2.19 mL | 4.38 mL | 6.57 mL | 13.2 mL | 21.9 mL |
| CuSO4(组分F) | 10 µL | 20 µL | 50 µL | 100µL | 150 µL | 300 µL | 500 µL |
| 叠氮化物荧光染料(Fluorescent dye azide) | 2.5 µL | 5 µL | 12.5 µL | 25 µL | 37.5 µL | 75 µL | 125 µL |
| 反应缓冲添加剂(在步骤24中制备) | 50 µL | 100 µL | 250 µL | 500 µL | 750 µL | 1.5mL | 2.5mL |
| 总反应体积 | 500 µL | 1mL | 2.5mL | 5mL | 7.5mL | 15mL | 25mL |
26. 在每管中加入0.5 mL Click-iT™ reaction cocktail并充分混匀。
27. 将反应混合物在室温下避光孵育30分钟。
28. 用3 mL的1X Click-iT™皂苷类破膜洗涤试剂(1X Click-iT™ saponin-based permeabilization and wash reagent)I在步骤4中制备)洗涤细胞一次,离心弃掉上清液。
如果继续“细胞表面或胞内染色”,用100 μL的1X Click-iT™皂苷类破膜洗涤试剂 ( 重悬细胞)。
如果继续做“DNA含量检测的细胞染色”,请添加500 μL 1X Click-iT破膜洗涤试剂。
DNA含量检测的染色步骤(可选)
29. 如有必要,将核糖核酸酶A (Ribonuclease A)添加到每个样本中并混匀(表3)。
30. 将DNA染料添加到每个样本中,充分混匀,并按照相应的染色条件进行孵育。
表3.Click-iT™ Plus EdU与DNA染料的兼容性
| Click-iT™ Plus EdU染色兼容性 | ||||||
| DNA染料 | 是否需要RNase ? | Alexa Fluor™ 350吡啶甲基叠氮化物 | Alexa Fluor™ 488吡啶甲基叠氮化物 | Alexa Fluor™ 594吡啶甲基叠氮化物 | Alexa Fluor™ 647吡啶甲基叠氮化物 | Pacific Blue™ 吡啶甲基叠氮化物 |
| FxCycle™ Violet | 否 | 是 | 是 | 否 | 是 | 是 |
| FxCycle™ Far Red | 否 | 否 | 是 | 是 | 是 | 否 |
| SYTOX™ AADvanced™染料 | 是 | 是 | 是 | 是 | 否 | 是 |
| 碘化丙啶(PI) | 是 | 是 | 是 | 是 | 是 | 是 |
| Propidium iodide (PI) | 是 | 是 | 是 | 否 | 是 | 是 |
用流式细胞仪分析
如果使用仅有鞘液聚焦的传统流式细胞仪检测DNA总量,则请采用低流速采集数据。如果用Attune™声波聚焦流式细胞仪检测,则无论是高流速或低流速,只要进样速度保持在每秒10,000个事件以下,都不会影响信号的准确性。但是,对于同一实验中的每个样本,应尽量使每个样本细胞浓度相通并保持相同的采集速率。DNA染料产生的荧光信号最好通过线性(Linear)放大信号进行检测。Click-iT™ Plus EdU标记产生的荧光信号最好通过对数(Log)放大信号进行检测。
31. 使用流式细胞仪对细胞进行分析。
| 使用以下各项检测EdU: | 使用: |
| Alexa Fluor™ 350吡啶甲基叠氮化物 | 使用350 nm激发和440滤光片(450/50 nm或类似通道) |
| Alexa Fluor™ 488吡啶甲基叠氮化物 | 使用488 nm激发和绿色滤光片(530/30 nm或类似通道) |
| Alexa Fluor™ 594吡啶甲基叠氮化物 | 使用532或561 nm激发和620滤光片(620/15 nm或类似通道) |
| Alexa Fluor™ 647吡啶甲基叠氮化物 | 使用633/635 nm激发和红色滤光片(660/20 nm或类似通道) |
| Pacific Blue™ 吡啶甲基叠氮化物 | 使用405 nm激发和紫色滤光片(450/40 nm或类似通道) |
参考文献
1. Chembiochem 4, 1147 (2003)
2. J Am Chem Soc 125, 3192 (2003)
3. Angew Chem Int Ed Engl 41, 2596 (2002)
4. Angew Chem Int Ed Engl 40, 2004 (2001)
5. BioTechniques 44, 927 (2008)
6. Curr Protoc Cytom 55, 7.38.1 (2011).
2. T细胞增殖功能检测
细胞增殖代次可视化检测
CellTrace Violet试剂盒用于通过染料稀释来监测不同代的增殖细胞。使用明亮且稳定的染料共价标记活细胞。每一代细胞在流式细胞直方图上显示为不同的、连续同的峰。
注:本方案适用于流式细胞术检测细胞增殖
警告:本方案不适用于荧光显微镜或酶标仪
本方案需要以下材料和试剂
• 10 mL肝素抗凝的外周全血
• CellTrace Violet细胞增殖试剂盒(CellTrace Violet Cell Proliferation Kit)(#C34557)
• OpTmizer T Cell Expansion SFM培养基(3A10485-01)
• 青霉素-链霉素-谷氨酰胺(Penicillin-Streptomycin-Glutamine)(100X)(#10378-016)
• PBS(#201054)
• 细胞计数仪,例如Countess II FL(#AMQAF1000)
• CD3功能性抗体(例如Anti-Human CD3 Antibody, Functional Grade, OKT3,#16-0037-81,或Anti-Mouse CD3e Monoclonal Antibody , 145-2C11, Functional Grade,#16-0031-85)。或者,CD28功能性抗体(例如Ant-Human CD28 Antibody, Functional Grade, CD28.2,#16-0289-81,或Anti-Mouse CD28 Antibody, Functional Grade, 37.51,#16-0281-82)
技术提示
• 保留1 mL未染色细胞用于未染色对照样本,再保留1 mL染色但未受刺激的细胞用于对照组。
• 分析每份样本时采集尽可能多的细胞。
• 使用活性染料,对活细胞圈门并继续进行流式分析。
实验步骤
配制完全培养基
- 在1 L OpTmizer T Cell Expansion SFM中,加入以下试剂:
– 26 mL T Cell Expansion Supplement (# A10485-01)
– 10 mL青霉素-链霉素-谷氨酰胺 - 此完全培养基在2–8°C避光条件下可稳定储存4周。
从全血中分离单个核细胞
- 用10 mL PBS稀释10 mL全血并充分混匀。
- 将15 mL Ficoll添加到50 mL离心管中,然后将20 mL稀释的全血轻轻加在上面。
- 400xg离心30分钟。
- 小心吸取淋巴细胞层并转移到新的50mL离心管中。
- 将细胞重悬于25 mL DPBS缓冲液中。
- 300 xg离心5分钟,去上清,再将细胞并重悬于25 mL DPBS中。
- 重复洗涤并用10 mL DPBS重悬细胞。
- 在Countess自动计数仪上或通过其他方法对细胞进行计数;将细胞浓度调整为106个细胞/mL。
从全血中分离单个核细胞
1.将20 μL DMSO加入到CellTrace Violet染色溶液中(制成储备溶液)。
2.将20 mL的PBS(加热至37°C)加入此储备液制成终浓度为5 μM染色溶液。
3.将10 mL的细胞添加到50 mL离心管中。
4.300xg离心5分钟,弃掉上清液。
5.用10 mL CellTrace Violet染色溶液重悬细胞。
6.将40 mL OpTmizer T细胞扩增SFM培养基加入细胞以吸收未结合的染料。
7.将细胞孵育5分钟。
8.300xg离心细胞5分钟,并用预温的OpTmizer T细胞扩增SFM培养基重悬细胞。
刺激和分析
1.将已染色细胞均匀接种到培养板或培养瓶中中。
2.每1mL细胞使用CD3/CD28功能性抗体或其他刺激物进行刺激(参考T细胞活化,第24页)。
3.在细胞适当的培养条件下孵育合适的时间。
4.孵育到适当的时间后,收获细胞并染色其他标记物。
5.在流式细胞仪上通过405 nm激发和450/40带通滤光片通道进行分析。
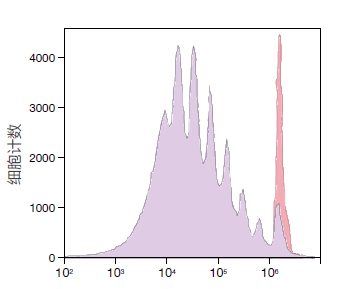
使用CellTrace Violet试剂对人PBMC进行染色并在培养基中刺激7天。此直方图中分开的几个峰代表连续增殖的几代活细胞。使用具有405 nm 激发和450/40 nm带通滤光片的Attune声波聚焦流式细胞仪完成分析。红色峰表示未刺激的初代细胞。
光谱信息和储存条件
| CellTrace Violet | |
| 激发/发射(nm) | 405/450 |
| 标准滤光片组 | Pacific Blue |
| 储存条件 | ≤ –20°C |