文章目录
细胞活性和凋亡
利用流式细胞术进行细胞凋亡和活性检测是一种常见的研究手段。本文详细介绍了不同检测方法所用的试剂和操作流程,以供参考。
1.细胞活性检测
介绍
细胞活性检测可用来区分活细胞与死细胞、探究细胞的其他功能或治疗作用,或者在流式分析时排除死细胞群。因为排除死细胞能够实现更加清晰的细胞分群和精确识别目标细胞群,因此区分出死细胞和排除假阳性细胞是确保流式实验结果分析准确性的关键步骤。 细胞凋亡过程的特点是细胞特征发生特殊变化,其中包括DNA含量减少、线粒体膜电位丧失和细胞膜内脂质不对称性破坏。这些变化均可以借助灵敏且特异性的染料和试剂进行性标记,并通过流式细胞术检测。
基于膜完整性的细胞活性检测
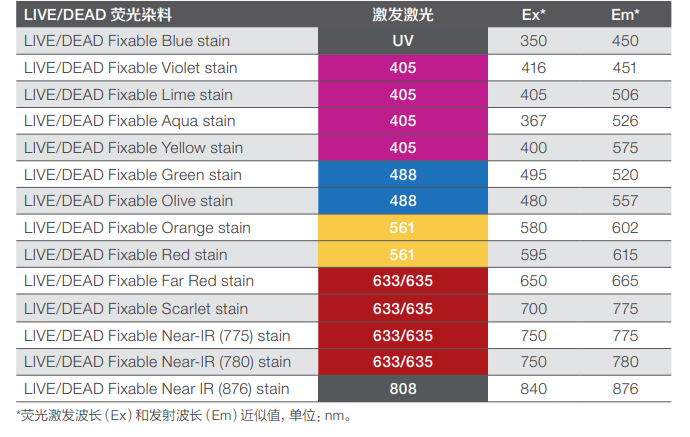
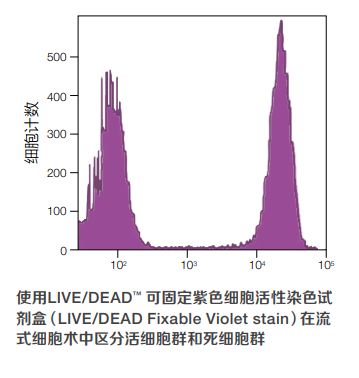
Invitrogen™ LIVE/DEAD™ 可固定细胞活性染料(LIVE/DEAD fixable dead cell stains)在 流式细胞术中用来区分活细胞和死细胞。在细胞膜受损的细胞中,染料与细胞内部和细胞表面的游离胺反应,产生很强的荧光染色信号。在活细胞中,染料仅与细胞表面的胺反应, 这时荧光强度较低。活细胞群和死细胞群之间的荧光强度差距通常大于50倍,这种荧光强度差距在甲醛固定后仍然完全保留。Invitrogen™ LIVE/DEAD™ 可固定细胞活性染料(LIVE/ DEAD fixable dead cell stains)能够对活细胞染色,且在固定后已标记的死活细胞的荧光强度仍然不变,对于流式的胞内免疫表型分析至关重要。 这些检测试剂盒仅占用流式细胞仪的一个通道,因此LIVE/DEAD™ 可固定细胞活性试剂盒 (LIVE/DEAD fixable dead cell stains)的荧光染料在多色流式实验中兼容性很高(参见下面的表格);在所使用的流式细胞仪中,选取哪个通道适合检测这些荧光染料,可能因仪器配置不同而发生变化。
以下实验方案用于:
• 使用流式细胞仪鉴别活细胞群和死细胞群
实验方案所需材料:
• 培养的细胞
• LIVE/DEAD™ 可固定细胞活性染料(LIVE/DEAD fxable dead cell stains)(如LIVE/ DEAD™ 可固定绿色细胞活性染料试剂盒LIVE/DEAD Fixable Green Dead Cell Stain Kit [# L23101])
• 流式细胞仪
注:
ArC™ 胺反应补偿微球试剂盒:
Invitrogen™ ArC™ 胺反应补偿微球试剂盒ArC™ Amine Reactive Compensation Bead Kit [# A10346] 可以用来矫正 可固定细胞活性染料与其他标准荧光 染料之间的光谱重叠,用来搭配LIVE/ DEAD™ 可固定细胞活性试剂(LIVE/ DEAD fxable dead cell stains)。这种补偿微球中含有两种聚苯乙烯微球:其中ArC反应性微球,可与LIVE/DEAD™ 可固定细胞活性染色试剂盒LIVE/DEAD fxable dead cell stains中的所有荧光染料发生反应;阴性对照微球则不发生反应。当与LIVE/DEAD™ 可固定细胞活性染料LIVE/DEAD fxable dead cell stains进行染色后,这两种微球分别显示阴性群和阳性群,用来更准确地设置补偿。
实验方案
1. 将试剂管中的染料解冻。
2. 向管中加入50μL DMSO来溶解LIVE/DEAD™ 可固定细胞活性染料(LIVE/DEAD fxable dead cell stains)。
3. 将细胞样本离心,弃掉上清液,样本所含细胞数需至少1×106 个细胞。
4. 用1 mL PBS对细胞洗涤一次。
5. 在1 mL PBS中重悬细胞。
6. 细胞计数并使用PBS将浓度调为1×106个细胞/mL。
7. 向细胞悬液中加入1μL溶解后的染料并混合均匀。
8. 在室温下孵育30分钟或在冰上孵育30分钟,避光。
9. 用1 mL PBS对细胞洗涤一次,然后在900μL PBS中重悬细胞。
10. 加入100μL 37%的甲醛。
11. 在室温下孵育15分钟。
12. 用1 mL含有1%牛血清白蛋白的PBS洗涤一次,然后在1 mL含有1%牛血清白蛋白的 PBS中重悬细胞。
13. 在流式细胞仪上选择合适的激发光和检测通道进行分析。
注:
若无需固定细胞,则可以跳过第9-12步。 相应地,用1 mL含有1%牛血清白蛋白的 PBS洗涤两次,然后在1 mL含有1%牛血清白蛋白的PBS中重悬细胞。
LIVE/DEAD™ 染料发射光谱特征
技术提示:
• 尽快使用染料溶液,最好在重溶后的几小时内使用。
• 细胞浓度应为1×104 -1×106 个细胞/ mL。
• 染色后,洗涤是可选步骤。
• 固定后细胞染色仍然保持不变,但固定不是必须步骤。
• 缓冲液中的蛋白浓度应<1%
2.Annexin V细胞凋亡检测
介绍
Annexin V细胞凋亡检测方案是流式细胞术检测细胞凋亡常用方法。在以下实验方案中, 建议使用相应的流式检测试剂盒。请参阅Annexin V染色实验方案,确定常规实验条件, 避免假阳性
注:
实验方案适用于方案中提到的产品,不建议更换其他产品。
流式检测Annexin V细胞凋亡实验方案
• Annexin V染色实验方案
• 同时使用可固定细胞活性染料的Annexin V染色实验方案
• 同时细胞表面和胞内染色的Annexin V染色实验方案
Annexin V染色实验方案
材料
• Annexin V细胞凋亡检测试剂盒Annexin V Apoptosis Detection kit(如PBM Annexin V试剂盒),每个试剂盒均有一支Annexin V偶联物。
• 10X 结合缓冲液(10X Binding buffer# 604005)
– FITC(# BMS500FI-300,88-8005-72 )
– PerCP-eFluor 710(# 88-8008-72)
• 12 × 75 mm 圆底流式管
注:
• 由于Annexin V与磷脂酰丝氨酸(PS)相 互作用具有钙依赖性,因此要注意在 Annexin V实验中需避免使用含有EDTA 或其他钙螯合剂的缓冲液。
• Annexin V仅在细胞质膜完整时作为细胞凋亡的标志物,因为破坏细胞质膜的整性将使Annexin V与细胞内的磷脂酰丝氨酸结合。
• 如上文所述,Annexin V通过结合磷脂酰丝氨酸(PS)鉴别细胞是否在凋亡过程中。 即使在细胞凋亡后期,细胞膜丧失完整性,Annexin V还能结合到胞内的PS。但碘化丙啶(PI)、7-AAD这些活性染料不能鉴别凋亡早期细胞,因其质膜不能染色。因 此,凋亡早期阶段细胞表现为Annexin V阳性,活性染料阴性;凋亡晚期阶段细胞和 坏死细胞都可发现Annexin V和活性染料 阳性:这都说明Annexin V能够鉴定细胞早期凋亡。
实验步骤
1. 将1份体积10X 结合缓冲液10X Binding buffer与9份体积蒸馏水混合,制备1X 结合缓冲液(Binding buffer)。
2. 收集细胞。
3. 用1X PBS洗涤细胞一次,然后用1X结合缓冲液洗涤细胞一次。
4. 用1X结合缓冲液重悬细胞至1-5×106 个细胞/mL。
5. 向100 µL细胞悬液中加入5 µL荧光染料偶联的Annexin V试剂。
6. 在室温下孵育10-15分钟,避光。
7. 加入2 mL 1X结合缓冲液,并在室温下400–600x g离心5分钟。弃掉上清液。
8. 在200 µL 1X结合缓冲液中重悬细胞。
9. 加入5 µL碘化丙啶(PI)染色液,(Propidium Iodide (PI) Staining Solution,货号00- 6990)或7-AAD细胞活性染色液(7-AAD Viability Staining Solution,货号225693)然 后在冰上或室温下孵育5-15分钟。 10. 用流式细胞仪进行分析。
注
• 在数据采集过程中,PI和7-AAD必须保留在缓冲液中。加入PI或7-AAD后不能洗涤细胞。
• 细胞应在加入细胞活性染料开始孵育的 4小时内上机分析,因为细胞长期在PI或 7-AAD中会对细胞活性产生影响。请在 2-8°C下避光存放,直到上机分析。
同时使用可固定活性染料的Annexin V染色方案
材料
• 可固定活性染料,如LIVE/DEAD™ 可固定细胞活性试剂盒LIVE/DEAD fxable dead cell stains
• Annexin V 细胞凋亡检测试剂盒Annexin V Apoptosis Detection kit,每个试剂盒均有一支荧光素偶联的Annexin V试剂。
• 10X 结合缓冲液(10X Binding buffer# 604005)
– FITC(# BMS500FI-300,88-8005-72 )
– PerCP-eFluor 710(# 88-8008-72)
• 流式染色缓冲液Flow Cytometry Staining Buffer(# 222057)
• 1X PBS(不含叠氮化物且不含血清/蛋白的PBS)
• 12 × 75 mm圆底流式管
实验步骤
1. 将1份体积10X结合缓冲液与9份体积蒸馏水混合,制备1X结合缓冲液。
2. 用不含叠氮化物且不含血清/蛋白的PBS洗涤细胞两次。
3. 在不含叠氮化物且不含血清/蛋白的PBS中重悬细胞至1–10×106 个细胞/mL。
4. 加入1 µL 可固定活性染料/ mL细胞悬液,立即涡旋。
5. 在2-8°C下孵育30分钟,避光。
6. 用流式染色缓冲液(Flow Cytometry Staining Buffer)或等同溶液洗涤细胞两次。
7. 用1X结合缓冲液洗涤细胞一次。
8. 用1X结合缓冲液重悬细胞至1-5×106 个细胞/mL。
9. 向100 µL细胞悬液中加入5 µL荧光染料偶联的Annexin V试剂。
10. 在室温下孵育10-15分钟,避光。
11. 加入2 mL 1X结合缓冲液,并在室温400–600x g下离心5分钟。弃掉上清液。
12. 在200 µL 1X结合缓冲液中重悬细胞。
13. 使用流式细胞仪进行分析。
同时细胞表面和胞内染色的Annexin V染色方案
材料
• Foxp3/转录因子固定破膜染色液套件(Foxp3/Transcription Factor Staining Buffer Set(# 00-5523))或细胞内固定破膜缓冲液套件(Intracellular Fixation & Permeabilization Buffer Set(货号88-8824))
• 流式染色缓冲液Flow Cytometry Staining Buffer(# 222057)
• Annexin V细胞凋亡检测试剂盒Annexin V Apoptosis Detectionkit(如赛默飞 Annexin V试剂盒),每个试剂盒均有一支荧光素偶联的Annexin V试剂。
• 10X 结合缓冲液(10X Binding buffer# 604005)
– FITC(# BMS500FI-300,88-8005-72 )
– PerCP-eFluor 710(# 88-8008-72)
• Fixable Viability Dye eFluor 660(# 65-0864-14)、Fixable Viability Dye eFluor 506(# 65-0866-14)或Fixable Viability Dye eFluor 780(货号65-0865-14)
• 12×75 mm圆底流式管
• 1×PBS(不含叠氮化物且不含血清/蛋白的PBS)
注
建议不要将Fixable Viability Dye eFluor 450与Annexin V细胞凋亡检测试剂盒一起使用。
实验步骤
1. 将1份体积10X结合缓冲液与9份体积蒸馏水混合,制备1X结合缓冲液。
2. 染色细胞表面抗原。
3. 用不含叠氮化物且不含血清/蛋白质的PBS中洗涤细胞两次。
4. 在不含叠氮化物且不含血清/蛋白质的PBS中重悬细胞至1–10×106 个细胞/mL。
5. 加入1 µL可固定活性染料Fixable Viability Dye / mL细胞悬液,立即涡旋混匀。
6. 在2-8°C下孵育30分钟,避光。
7. 用流式细胞染色缓冲液(Flow Cytometry Staining Buffer)或等同溶液洗涤细胞两次。
8. 用1X结合缓冲液洗涤细胞一次。
9. 用1X结合缓冲液重悬细胞至1-5×106 个细胞/mL。
10. 向100 µL细胞悬液中加入5 µL荧光染料偶联的Annexin V试剂。
11. 在室温下孵育10-15分钟,避光。
12. 用1X结合缓冲液洗涤细胞一次。
13. 染色细胞内抗原。
14. 使用流式细胞仪进行分析。
3.喜树碱诱导细胞凋亡
介绍
与细胞凋亡相关的细胞死亡级联反应是复杂且动态的过程,可以通过多种检测形式进行评价。采用实验性细胞凋亡阳性对照可以在一定程度上提高数据分析的准确性,并可用来确认实验是否操作正确。虽然阳性对照不是必须项,但是这能够使实验操作更加规范。以下方案是关于细胞凋亡检测中阳性对照诱导的细胞凋亡实验方案,具体来说是使用喜树碱诱导细胞凋亡方案。
注:
实验方案适用于方案中提及的产品,不建议更换其他产品。
喜树碱(Camptothecin)诱导的细胞凋亡实验方案
材料
• 容易诱导细胞凋亡的细胞系或原代细胞。
• 添加10% FBS的RPMI-1640培养基
• 在DMSO中制备1 mM的喜树碱储备液
• 组织培养瓶或组织培养板
实验步骤
1. 在所需的组织培养瓶或组织培养板中,用10% FBS在新鲜的RPMI-1640培养基将细胞混悬为浓度为0.5 × 106 个/mL的细胞悬液。
2. 在细胞悬液中加入适量的1 mM喜树碱,使终浓度达到4–6 µM。阴性对照是由 DMSO等量稀释的细胞悬液。
3. 在37°C,5% CO2 培养箱中孵育细胞,孵育时间为该细胞类型的最佳诱导时间。建议您在预实验中测试出最佳孵育时间,以了解该细胞类型对凋亡过程的敏感程度。
4. 通过离心收集细胞,并进行适合的检测以评价细胞凋亡的诱导结果。
注:
成功诱导细胞凋亡的其他药物有:放线菌素D、蚜肠霉素、放线菌酮、地塞米松、5-氟尿嘧啶、羟基脲和星形孢菌素。