文章目录
细胞分选
细胞分选
1.细胞分选方法
|
|
流式分选 |
磁珠有柱分选 |
磁珠无柱分选 |
|
细胞纯度 |
+++ |
++ |
+± |
|
细胞活性 |
差 |
高 |
高 |
|
多参数分选 |
可以 |
1-2个生物标记 |
1-2个生物标记 |
|
分选速度 |
慢 |
快 |
快 |
|
仪器要求 |
流式细胞仪 |
手动分选或仪器分选 |
手动分选或仪器分选 |
|
技术要求 |
专门技术人员 |
无需技术人员 |
无需技术人员 |
2. 样本处理
2.1 人全血样本处理
| 货号 | 名称 |
| LSB1077 | ImunoSep™密度梯度细胞分离液 |
| 601115 | SepTube™-15密度梯度离心管 |
| 601150 | SepTube™-50密度梯度离心管 |
| 339651 | 15mL离心管 |
| 339652 | 50mL离心管 |
| 604050 | ImunoSep™ 细胞分选缓冲液 |
操作步骤:
SepTube™密度梯度离心管用于通过密度梯度离心从外周血、脐带血或骨髓中分离单个核细胞(Mononuclear cells, MNCs. 包括淋巴细胞和单核细胞)。
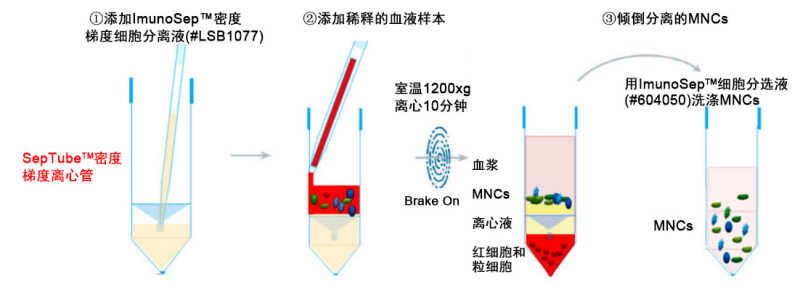
为取得较好的 MNCs 分离效果,请确保 ImunoSep™细胞分选液(#604050)、ImunoSep™密度梯度 细胞分离液(#LSB1077)和离心机在室温(15-25℃)状态下。
(1) 用等体积 ImunoSep™细胞分选液(#604050)稀释抗凝血,混合均匀。如:5 mL 抗凝血用 5 mL ImunoSep™细胞分选液(#604050)稀释。
(2) 将 ImunoSep™密度梯度细胞分离液(#LSB1077)通过隔板中心的孔注入 SepTube™密度梯度离心管 (如上图 1①)。注入分离液的体积请参考下表。
| SepTube™密度梯度离心管 | ImunoSep™密度梯度细胞分离液(mL) | 稀释的抗凝血样本体积(mL) |
| SepTube™-15 | 4.5 | 1-10 |
| SepTube™-50 | 15 | 8-34 |
注:正常情况,加完的分离液应超过隔板2-3 mm。
(3) 保持 SepTube™密度梯度离心管垂直,通过血清移液管将稀释的样品沿管壁加入管中(如上图 1②)。 样品将会和隔板上方的分离液混合,但不会影响分离效果。
注:样品也可以直接倒入SepTube®管中,但要小心避免样品通过隔板中央的小孔直接进入隔板下方的分离液中。
(4) 水平转子离心机,室温1200×g离心10分钟。无需关闭离心机制动。
注:如果样品在体外超过24h以上,建议离心20分钟以上。
离心力(g)和转速(rpm)转换公式:

注:rpm:每分钟转速;RCF:相对离心力;Radius:离心机转子半径(cm)
(5) 离心完成后,将隔板上方包含MNCs和血浆的混合液直接倒入新的离心管中。
注:此时,切勿吸取上层血浆,然后收集细胞。因为离心后隔板上方分层可能不明显,如此操作会丢失部分细胞。
注:请勿倒置SepTube™密度梯度离心管超过2秒,以免倒出底层红细胞与粒细胞。
注:离心后,SepTube™密度梯度离心管隔板上表面可能存在少量红细胞,但这些少量的红细胞不会影响下游实验。如果SepTube™密度梯度离心管隔板上表面发现有较多的红细胞,可能是由于采血时间较长引起的,此时可以继续1200×g离心10分钟,以减少红细胞的残留。
(6) 在MNCs离心管中添加5-1倍体积ImunoSep™细胞分选液(#604050),室温300×g离心8分钟洗涤细胞。
(7) 弃上清。
(8) 重复步骤6)和7)。
(9) 重悬细胞备用。